Christoph Höner Zu Siederdissen, Hannover
Hepatitis B: Nukleos(t)idanaloga absetzen – eine mögliche Strategie?
Der positive Effekt einer antiviralen Therapie der Hepatitis-B-Virusinfektion mit Nukleos(t)idanaloga bei aktiver Hepatitis und einer HBV-DNA >2.000 IU/ml bzw. 20.000 IU/ml auf die Entwicklung einer Leberzirrhose, eines hepatozellulären Karzinoms und die Mortalität ist hinreichend belegt. Eine Therapie wird daher für Patienten mit aktiver Hepatitis in den asiatischen, europäischen und amerikanischen Leitlinien empfohlen.1-3 Weniger Evidenz gibt es für die Beendigung einer antiviralen Therapie. Der nach derzeitigem Kenntnisstand optimale Zeitpunkt eine Therapie mit Nukleos(t)idanaloga zu beenden, ist die HBsAg Serokonversion. Dies ist vergleichbar mit einer immunologischen Kontrolle der Hepatitis-B-Virusinfektion mit der langfristig besten Prognose.4 Problematisch ist, dass der HBsAg-Verlust unter Therapie mit Nukleos(t)idanaloga jedoch eher selten ist und im Durchschnitt erst nach jahrzehntelanger Therapie eintritt.5
Datenlage
In Studien wurde jedoch der Effekt des Absetzens der Therapie mit Nukleos(t)idanaloga vor HBsAg-Verlust untersucht. Hierbei wurde die antivirale Behandlung bei HBeAg-negativen Patienten im Regelfall nach einer meist mehrjährigen virologischen Remission unter Therapie mit Nukleos(t)idanaloga beendet. Bei HBeAg-positiven Patienten wurde die anti-HBe-Serokonversion abgewartet und die antivirale Medikation erst nach einer Konsolidierungstherapie abgesetzt.
Wesentliches Risiko des Absetzens der Medikation ist, das es häufig zu einem virologischen Relapse (Wideranstieg der HBV-DNA >2.000 IU/ml bzw. 20.000 IU/ml) und mit zeitlichem Abstand zu einem biochemischen Relapse (Anstieg der ALT) und damit zu einer klinisch relevanten Reaktivierung der Hepatitis kommt.6 Das Risiko für eine Reaktivierung hängt dabei von verschiedenen Faktoren ab: HBsAg-Spiegel, HBeAg-Status, Immunsuppression, Dauer der Therapie bzw. der HBV-DNA Suppression sowie Stadium der Leberfibrose und Alter des Patienten.7,8 Im Folgenden werden die bisherigen Ergebnisse unterteilt nach HBeAg-Status dargestellt.
HBeAg-positive Patienten
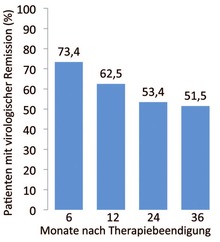
Abb. 1 Virologische Remission nach Therapiebeendigung in HBeAg-positiven Patienten
Die umfangreichsten Daten zum Therapie-Stop bei initial HBeAg-positiven Patienten nach HBeAg-Verlust und anti-HBe-Serokonversion wurden in einer Metaanalyse an 1.217 HBeAg-positiven Patienten erhoben.7 Insgesamt zeigten 62,5% der Patienten ein Jahr nach Therapieende eine virologische Remission (HBV-DNA <20.000 IU/ml) (Abb. 1). Eine biochemische Remission wurde bei 66,5% (von 403 Patienten mit entsprechenden Daten) beschrieben. Die HBeAg-Serokonversion war bei 91,9% der Patienten ein Jahr nach Therapiebeendigung stabil und sank auch in den nächsten Jahren nicht wesentlich ab.
Patienten, die in vergleichenden Studien die antivirale Therapie fortgeführt haben, zeigten erwartungsgemäß eine deutlich höhere Rate an virologischer und biochemischer Remission. Ebenso trat eine HBeAg-Reversion unter antiviraler Therapie nicht auf.9,10 Ein Vergleich zum langfristigen Verlauf hinsichtlich Mortalität, Progress der Lebererkrankung und Risiko für ein hepatozelluläres Karzinom zwischen Patientengruppen mit fortgeführter antiviraler Therapie bzw. beendeter antiviraler Therapie nach HBeAg-Serokonversion liegen nicht vor.
Positive Prädiktoren
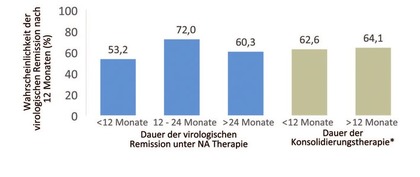
Abb. 2 Faktoren, die mit virologischer Remission bei HBeAg-positiven Patienten assoziiert sind
Einige Faktoren sind mit einer höheren Wahrscheinlichkeit für eine dauerhafte Remission assoziiert. Bei heterogener Datenlage zeigte sich eine erhöhte Wahrscheinlichkeit für eine dauerhafte Remission bei jüngeren Patienten und Patienten mit niedrigerem HBsAg-Spiegel.7 Weiterhin führte eine virologische Remission unter Therapie mit Nukleos(t)idanaloga >12 Monate mit größerer Wahrscheinlichkeit zu einer dauerhaften Remission (Abb. 2). Eine Konsolidierungstherapie von >12 Monaten nach anti-HBe-Serokonversion war in der Metaanalyse nicht signifikant besser (bei kleinen Fallzahlen)7, jedoch ist dieses Vorgehen im Einklang mit internationalen Leitlinien und der Praxis in den bisher durchgeführten Studien sinnvoll.1–3
Einschränkend muss darauf hingewiesen werden, dass die bisherigen Studien eine große Heterogenität aufweisen und nahezu ausschließlich in Asien durchgeführt wurden. Die vorherrschenden Genotypen waren B und C. Ein Einfluss der Genotypen und auch ein Einfluss bestimmter Nukleos(t)idanaloga lässt sich bisher nicht belegen.
HBeAg-negative Patienten
Die
Erfahrungen zum Beenden einer antiviralen Therapie bei
HBeAg-negativen Patienten wurden in zwei systematischen Reviews mit
1.732 und 1.115 Patienten zusammengefasst.7,8
Die untersuchten Studien überschneiden sich dabei zu großen Teilen
und wurden überwiegend im asiatischen Raum durchgeführt, so dass
die Übertragbarkeit auf Deutschland hier auch eingeschränkt ist.
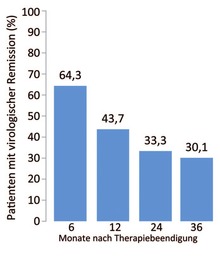
Abb. 3 Virologische Remission nach Therapiebeendigung in HBeAg-negativen Patienten
Die Wahrscheinlichkeit für eine virologische Remission (HBV-DNA <20.000 IU/ml) ein Jahr nach Absetzen der antiviralen Therapie lag bei HBeAg-negativen Patienten bei 43,7%. Eine biochemische Remission bestand bei 57,4% (basierend auf Daten von 687 Patienten zu denen entsprechende Ergebnisse vorlagen) (Abb. 3).
Erneut zeigte sich die Dauer der virologischen Remission unter antiviraler Therapie als prognostisch wichtig. Wenn zuvor eine virologische Remission unter antiviraler Therapie für mindestens 24 Monate bestanden hatte, war die Wahrscheinlichkeit für eine spätere virologische Remission nach Absetzen höher (Odds ratio 3.00 (0.39-23.30) (Abb. 4).8 Eine Studie mit längerer Verlaufsbeobachtung zeigte eine weiter reduzierte Rückfallquote bei antiviraler Therapie von mindestens drei Jahren gegenüber zwei Jahren in 59 Patienten (25% vs. 54%).11
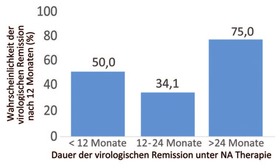
Abb. 4 Faktoren, die mit virologischer Remission in HBeAg-negativen Patienten assoziiert sind
Weitere Prädiktoren in einzelnen Studien waren niedrigere Ausgangsviruslast bei Therapiebeginn (<200.000 IU/ml), niedrigere ALT, jüngeres Alter (<40 Jahre), weibliches Geschlecht und Fehlen einer Leberzirrhose. Ebenfalls war ein niedrigerer HBsAg-Spiegel (<200 IU/ml bzw. <100 IU/ml) zum Zeitpunkt des Absetzens mit einer erhöhten Wahrscheinlichkeit für eine dauerhafte Remission assoziiert.7,8,12-14 Langzeitdaten hinsichtlich Mortalität, Risiko für HCC und hepatischer Dekompensation im Vergleich zu einer fortgesetzten Therapie liegen auch hier nicht vor.
Sicherheit
Patienten
mit weiteren Lebererkrankungen oder immunsuppressiv behandelte
Patienten waren in den Studien
regelhaft ausgeschlossen, so dass
zu diesen Patienten keine belastbaren Daten vorliegen. Bei
ausgeprägten Komorbiditäten oder Immunsuppression ist aufgrund der
hohen Gefahr einer Reaktivierung ein Absetzen einer HBV-Therapie
nicht zu empfehlen. Der Anteil an Patienten mit Leberzirrhose lag in
den Studien, die in den systematischen Reviews erfasst wurden, bei
9,3% und 16,1%.
Insgesamt wurden in den Studien keine gehäuften schweren Nebenwirkungen beschrieben. Allerdings kam es nach Beendigung der antiviralen Therapie in Einzelfällen bei Leberzirrhose zu einer hepatischen Dekompensation6, die nicht in jedem Fall durch eine Re-Therapie erfolgreich behandelt werden konnte. Deshalb kann unter Sicherheitsaspekten ein Therapie-Stopp bei Patienten mit Leberzirrhose nicht empfohlen werden.
Kontrollen und Re-Therapie
Ein virologischer und biochemischer Relapse tritt in der Regel innerhalb des ersten Jahres auf, so dass nach Absetzen der Medikation mindestens alle drei Monate eine Kontrolle von Viruslast und Transaminasen (HBV-DNA und ALT) erfolgen sollte. Bei HBeAg-negativen Patienten können häufigere Kontrollen sinnvoll sein. Da der Anstieg der HBV-DNA dem Anstieg der ALT vorangeht, ist bei einem virologischen Relapse eine engmaschige Kontrolle empfehlenswert. Die optimalen Kontrollintervalle nach Therapiebeendigung sind allerdings bislang nicht gut definiert. Möglicherweise gibt es auch Unterschiede zwischen den verschiedenen Nukleos(t)idanaloga. In einer Studie kam es nach Absetzen von Tenofovir deutlich schneller zum Rebound als nach Absetzen von Entecavir. Nach 12 Wochen war bei >70% der Tenofovir-Patienten, aber nur bei <10% der Entecavir-Patienten die Viruslast >2.000 IU/ml angestiegen.17 Generell gilt, dass bei fortgeschrittener Fibrose engmaschiger kontrolliert werden sollte. Ebenfalls muss man auf klinische Zeichen der hepatischen Dekompensation achten.
Eine ggf. erforderliche Re-Therapie sollte den üblichen Leitlinienempfehlungen zur Therapie der Hepatitis B folgen. Bisher konnte in den durchgeführten Studien unter Verwendung von Entecavir und Tenofovir in der Regel eine erneute virale Suppression erreicht werden. In den zur Verfügung stehenden Daten ergeben sich keine Hinweise für ein schlechteres Ansprechen auf eine erneute antivirale Therapie bzw. Resistenzentwicklung, allerdings liegen keine Daten zum langfristigen Verlauf vor.7,8
Ausblick
Ein möglicher weiterer Benefit einer Therapiebeendigung ist die am ehesten immunogen vermittelte HBsAg-Reduktion bzw. Induktion eines HBsAg-Verlustes. In mehreren kleineren Studien an europäischen Patienten wurden solche Effekte beobachtet.15,16 Vorläufige Ergebnisse einer prospektiven Studie, die ein Absetzen der Therapie mit einer Fortführung verglich, zeigen ähnliche Resultate. Prädiktiv für einen späteren HBsAg-Verlust scheint ein niedriges HBsAg zum Zeitpunkt der Therapiebeendigung zu sein (HBsAg <200 IU/ml bzw. <100 IU/ml).
Zusammenfassung
Zusammenfassend bleibt die Beendigung einer antiviralen Therapie bei Hepatitis B ein spannendes Konzept, das sich in den letzten Jahren erheblich weiterentwickelt hat. Der Therapie-Stopp nach anti-HBe-Serokonversion ist fester Bestandteil der Leitlinienempfehlungen und kann entsprechend mit dem Patienten besprochen werden. Aufgrund der Unsicherheit, welche Patienten für einen Therapiestopp geeignet sind, ist allerdings auch eine Fortführung der Therapie bis zum Erreichen eines HBsAg-Verlustes zu diskutieren.
Eine Therapiebeendigung bei HBeAg-negativen Patienten erscheint grundsätzlich möglich und wird auch in den aktuellen Leitlinien als Option genannt. Favorisiert wird jedoch basierend auf den bisher verfügbaren Daten, die primär im asiatischen Raum erhoben wurden, eindeutig die Therapiefortführung. Entscheidend für eine Therapiebeendigung bei HBeAg-negativen Patienten dürfte das Vorliegen von positiv bzw. negativ prädiktiven Parametern für eine dauerhafte Remission ohne Therapie sein.
Grundsätzlich gilt für die Praxis: Ein Therapie-Stopp sollte nur unter sehr engmaschiger Kontrolle eines hepatologisch erfahrenen Arztes bei nicht-zirrhotischen Patienten durchgeführt werden. Eine Therapiebeendigung mit dem Ziel einer HBsAg-Reduktion ist als experimentell anzusehen.
1 Lampertico P, Agarwal K, Berg T, et al. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. 2017.
2 Terrault N A, Bzowej N H, Chang K-M, et al. AASLD guidelines for treatment of chronic hepatitis B. Hepatology. 2015; 63:n/a-n/a.
3 Sarin S K, Kumar M, Lau G K, et al. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update. Springer India; 2016.
4 Kim G-A, Lim Y-S, An J, et al. HBsAg seroclearance after nucleoside analogue therapy in patients with chronic hepatitis B: clinical outcomes and durability. Gut. 2014; 63:1325-32.
5 Chevaliez S, Hézode C, Bahrami S, Grare M, Pawlotsky J-M. Long-term hepatitis B surface antigen (HBsAg) kinetics during nucleoside/nucleotide analogue therapy: Finite treatment duration unlikely. J Hepatol. 2012; 58:683-676.
6 Jeng W-J, Sheen I-S, Chen Y-C, et al. Off-therapy durability of response to entecavir therapy in hepatitis B e antigen-negative chronic hepatitis B patients. Hepatology. 2013; 58:1888-96.
7 Papatheodoridis G, Vlachogiannakos I, Cholongitas E, et al. Discontinuation of oral antivirals in chronic hepatitis B: A systematic review. Hepatology. 2016; 63:1481-1492.
8 Chang M-L, Liaw Y-F, Hadziyannis S J. Systematic review: cessation of long-term nucleos(t)ide analogue therapy in patients with hepatitis B e antigen-negative chronic hepatitis B. Aliment. Pharmacol. Ther. 2015; 42:243-257.
9 Chaung K T, Ha N B, Trinh H N, et al. High frequency of recurrent viremia after hepatitis B e antigen seroconversion and consolidation therapy. J. Clin. Gastroenterol. 2012; 46:865-70.
10 Fung J, Lai C-L, Tanaka Y, et al. The duration of lamivudine therapy for chronic hepatitis B: cessation vs. continuation of treatment after HBeAg seroconversion. Am. J. Gastroenterol. 2009; 104:1940-1946; quiz 1947.
11 Chi H, Hansen B E, Yim C, et al. Reduced risk of relapse after long-term nucleos(t)ide analogue consolidation therapy for chronic hepatitis B. Aliment. Pharmacol. Ther. 2015; 41:867-76.
12 Wang C-C, Tseng K-C, Hsieh T-Y, et al. Assessing the Durability of Entecavir-Treated Hepatitis B Using Quantitative HBsAg. Am. J. Gastroenterol. 2016; 111:1286-1294.
13 Hsu Y-C, Mo L-R, Chang C-Y, et al. Association Between Serum Level of Hepatitis B Surface Antigen at End of Entecavir Therapy and Risk of Relapse in E Antigen–Negative Patients. Clin. Gastroenterol. Hepatol. 2016; 14:1490-1498.e3.
14 Qiu Y, Huang L, Yang W, et al. Hepatitis B surface antigen quantification at hepatitis B e antigen seroconversion predicts virological relapse after the cessation of entecavir treatment in hepatitis B e antigen-positive patients. Int. J. Infect. Dis. 2016; 43:43-48.
15 Hadziyannis S J, Sevastianos V, Rapti I, Vassilopoulos D, Hadziyannis E. Sustained responses and loss of HBsAg in HBeAg-negative patients with chronic hepatitis B who stop long-term treatment with adefovir. Gastroenterology. 2012; 143:629-36.e1.
16 Höner
zu Siederdissen C, Rinker F, Maasoumy B, et al. Viral and Host
Responses After Stopping Long-term Nucleos(t)ide Analogue Therapy in
HBeAg-Negative Chro-
nic Hepatitis B. J. Infect. Dis. 2016;
214:1492-1497.
17 Wedemeyer H et al., International Liver Congress, Amsterdam 2017, Abstract LBP-518.





