Eleni Koukoulioti und Thomas Berg, Leipzig
HCV-Therapie bei dekompensierter Leberzirrhose
Bei Patienten mit chronischer Hepatitis C ohne fortgeschrittene Fibrose können heute mit einer 8- oder 12-wöchigen Kombination aus direkt antiviral wirksamen Substanzen (DAA) Heilungsraten (SVR) von über 95% erreicht werden, mit Relapseraten von 1-2%. Die insgesamt hohe Sicherheit der Therapie ermöglichte auch erstmals die Therapie von Patienten mit fortgeschrittener Hepatitis C im Stadium der dekompensierten Zirrhose. Die Erfahrung zur DAA-Therapie bei dekompensierter Zirrhose und Patienten, die aufgrund der chronischen Hepatitis C auf der Warteliste zur Lebertransplantation stehen, sind jedoch noch relativ begrenzt. Es zeigt sich jedoch bereits jetzt, dass im Vergleich zur kompensierten Zirrhose im dekompensierten Stadium keine identischen Heilungsraten induziert werden können und auch das Sicherheitsprofil der unterschiedlichen DAAs differenziert betrachtet werden muss.
Insbesondere im Bezug auf den „Point of no return“, d.h. ab welchem Stadium der Dekompensation auch bei Heilung der HCV-Infektion nicht mehr von einer dauerhaften Rekompensation der Erkrankung auszugehen ist, bestehen Unsicherheiten. Für HCV-Infizierte auf der Lebertransplantationswarteliste muss daher eine individuelle Entscheidung getroffen werden, ob die Therapie bereits vor Transplantation oder besser danach erfolgen soll. Das Risiko der HCC-Entwicklung nach erfolgreicher DAA-Therapie bleibt auch im Langzeitverlauf bestehen. Eine bessere Risikoeinschätzung ist für die Zukunft zu wünschen und es sind weitere Studien notwendig, die klären sollen, ob das HCC-Risiko direkt nach DAA-Therapie sogar erhöht sein könnte.
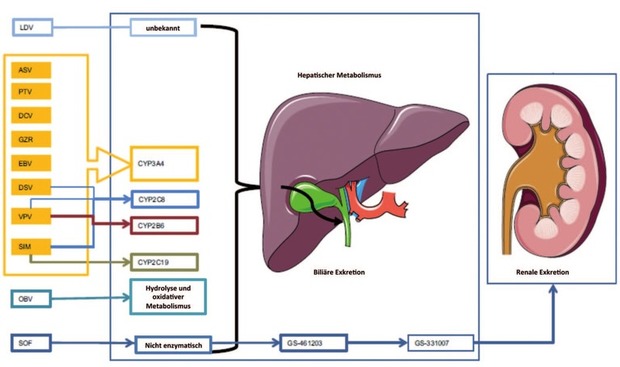
Abb. 1 Übersicht der hepatischen Stoffwechselwege der DAA (modifiziert von Smolders E et al., Drug Saf 2016 2 ). ASV = Asunaprevir, CYP = Cytochrom P450, DCV = Daclatasvir, DSV = Dasa - buvir, EBV = Elbasvir, GRZ = Grazoprevir, LDV = Ledipasvir, OBV = Ombitasvir, PTV = Paritapre - vir, RBV = Ribavirin, SIM = Simeprevir, SOF = Sofosbuvir, VPV = Velpatasvir.
Pharmakokinetik bei Zirrhose
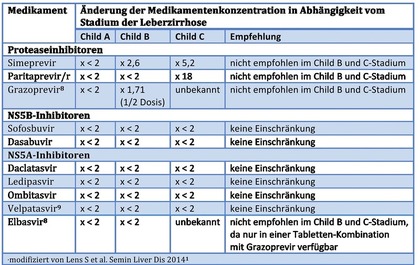
Tab. 1 Pharmakokinetik unterschiedlicher DAA bei Patienten mit Leberzirrhose verglichen mit Kontrollgruppen (Änderung der Medikamentenkonzentration)
Die meisten DAAs werden hepatisch metabolisiert über verschiedene CYP-Enzyme (Abb. 1). Für die Proteaseinhibitoren zeigte sich bei fortgeschrittener Leberfunktionseinschränkung eine veränderte Pharmakokinetik1,2, so dass Proteaseinhibitor-haltige Regimes in dieser Patientenpopulation nicht eingesetzt werden sollten (Tab. 1). Insbesondere ist die Dreifachkombination aus Paritaprevir/r, Ombitasvir und Dasabuvir für Patienten mit Leberzirrhose im Child-Stadium B und C kontraindiziert, da nach Zulassung dieses Regimes Dekompensationsfälle aufgetreten sind.3 Eine Pilotstudie zur Sicherheit und Wirksamkeit von Paritaprevir/r, Ombitasvir und Dasabuvir bei Patienten mit Child B und C musste trotz hoher Effektivität (100% SVR) aufgrund von ikterischen Dekompensationen vorzeitig abgebrochen werden.4 Auch für die Kombination von Sofosbuvir mit dem Proteaseinhibitor Simeprevir gibt es Erfahrungen zur Effektivität und Sicherheit beim Einsatz bei Patienten mit Zirrhose im Stadium Child B/C. Hier lagen die SVR-Raten in den verschiedenen Studien zwischen 73% und 83% und Therapieabbrüche oder schwerwiegende Nebenwirkungen/Dekompensationen traten bei bis zu 20% der Patienten auf.5-7 Simeprevir kann daher bei Patienten mit Leberzirrhose Child B oder C – auch vor dem Hintergrund sicherer DAA-Alternativen – nicht mehr empfohlen werden. Zu den neuen Fixkombinationen Glecaprevir/Pibrentasvir und Sofosbuvir/Velpatasvir/Voxilaprevir liegen noch keine Daten zum Einsatz bei dekompensierter Zirrhose vor. Es ist jedoch davon auszugehen, dass diese Regime, die beide einen Proteaseinhibitor enthalten, ebenfalls mit einer vergleichsweise erhöhten Nebenwirkungsrate in dieser Situation belastet sind.
Somit basiert die antivirale Therapie bei Patienten mit dekompensierter Leberzirrhose auf den nukleosidischen Polymeraseinhibitor Sofosbuvir (SOF) in Kombination mit einem NS5A-Inhibitor (Daclatasvir, Ledipasvir oder Velpatasvir) ± Ribavirin (RBV).
Effektivität
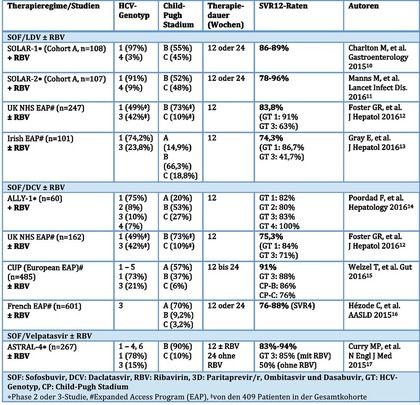
Tab. 2 Zusammenfassung der SVR-Raten aus Studien bei Patienten mit dekompensierter Leberzirrhose nach DAA-Kombinationstherapie (Daten nur für nicht transplantierte Patienten)
Die Tabelle 2 gibt eine Übersicht zu kontrollierten Studien und „Real-World“-Daten zur Effektivität einer Interferon-freien DAA-Therapie bei Patienten mit fortgeschrittener chronischer Hepatitis C im dekompensierten Stadium. Die SVR-Raten variieren in den vorliegenden Studien von 78% bis 96% (Tab. 2) in Abhängigkeit von der untersuchten Studienpopulation. Die Variabilität der Ergebnisse erklärt sich aus der Heterogenität der Populationen: Eingeschlossen wurden Patienten vor und nach Transplantation, Patienten mit Zirrhose im Stadium Child B und C mit unterschiedlicher HCV-Genotypenverteilung. Auch variieren die Therapieregime bzw. Therapiedauern (12 bis 24 Wochen), die zur Anwendung kamen. Außerdem sind die Erfahrungen im Child-Pugh C-Stadium insgesamt begrenzt, und nur ca. 10% (0-22%) der eingeschlossenen Patienten hatte einen MELD-Score >15.
Prädiktor Child-Pugh
Im Rahmen zweier kontrollierter Studien wurden Patienten mit Child B und C Zirrhose randomisiert und mit SOF und LDV plus RBV für 12 oder 24 Wochen behandelt (Charlton et al.10 und Manns et al.11). Die SVR-Raten waren zwischen den Patienten mit Child-Pugh B- und Child-Pugh C-Stadium vergleichbar (86-89%) unabhängig von der Therapiedauer. In der ALLY-1 Phase 3-Studie mit der Kombinationstherapie aus SOF und DCV plus RBV für 12 Wochen, welche lediglich 60 Patienten mit fortgeschrittener Leberzirrhose (davon 20% Child A-Stadium) und überwiegend HCV-Genotyp 1-Infektion einschloss, waren dagegen die SVR-Raten unter den Patienten mit Child-Pugh C-Zirrhose deutlich niedriger im Vergleich zu den Patienten mit Child A- oder B-Stadium (56% versus 83%). In der deutlich größeren Kohorte des europäischen Early Access Programms fand sich mit 76% ebenfalls eine geringere SVR Rate bei Child-Pugh C im Vergleich zu CP-B (86%), der Prozentsatz der Patienten im Child-Pugh C-Stadium betrug jedoch nur 6%.
Andere Prädiktoren
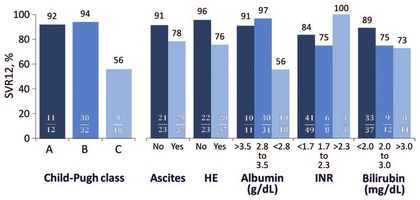
Abb. 2 SVR12-Raten in Abhängigkeit von Child-Pugh-Stadium und verschiedenen labor- chemischen und klinischen Parametern nach einer Therapie mit SOF, DAC und RBV für 12 Wochen (ALLY-1). 18 HE: hepatische Enzephalopathie
Neben dem Child-Pugh-Stadium besitzt auch der MELD-Score eine prognostische Relevanz für das Ausmaß des Therapieerfolgs. Patienten mit einem MELD-Score >15 zeigten insgesamt niedrigere SVR-Raten als Patienten mit einem MELD-Score ≤15 (61% vs 93%).15 Ein Effekt, der aber nicht allein auf ein höheres virologisches Therapieversagen zurückzuführen war. Auch die Zahl der Patienten mit vorzeitigen „Lebererkrankungs-bezogenen“ Therapieabbrüchen bzw. Tod unter Therapie war in dieser Gruppe höher.15 Das Vorhandensein von Aszites und hepatischer Enzephalopathie sowie ein Albuminwert <2,8 g/dl und Bilirubinwert >2 mg/dl waren ebenfalls mit niedrigeren SVR-Raten assoziiert (ALLY-114, Abb. 218). Ebenso zeigten Patienten mit HCV-Genotyp 1 und einer Thrombozytenzahl < 90.000 Gpt/l, Albuminwert <4 g/dl und Fibroscan >20 kPa niedrigere SVR-Raten im Vergleich zu der Kontrollgruppe (OPTIMIST-2).7
Response bei GT3
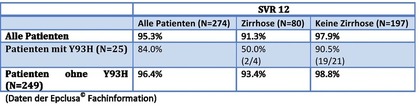
Tab. 3 SVR-Raten unter Therapie mit Sofosbuvir/Velpatasvir in Abhängigkeit von Baseline NS5A Y93H-RAV (ASTRAL 3 Studie)

Tab. 4 Empfehlungen für eine antivirale, interferonfreie Therapie bei dekompensierter Leberzirrhose (im Stadium Child-Pugh B oder C)
Patienten mit HCV-Genotyp 3-Infektion und Zirrhose gehören aktuell zu den am schwersten zu heilenden Patienten. Die SVR-Chance wird weiter eingeschränkt, wenn die Zirrhose in einem dekompensierten Stadium ist und der Patient bereits auf eine Interferon-basierte Therapie nicht angesprochen hat. Im Rahmen der Phase 3-Studie ASTRAL-4 wurden 39 Patienten mit HCV-Genotyp 3 und dekompensierter Zirrhose randomisiert und mit der Kombinationstherapie aus SOF und dem neuen pangenotypisch wirksamen NS5A-Inhibitor Velpatasvir für 12 Wochen entweder mit oder ohne RBV, oder für 24 Wochen ohne RBV behandelt. Die SVR-Raten für die RBV-freien Behandlungsarme lagen unabhängig von der Therapiedauer (12 oder 24 Wochen) bei 50%. Eine deutlich höhere SVR-Rate von 85% konnte für die Patienten im 12-Wochenarm unter der Zugabe von Ribavirin erzielt werden.17 Vergleichbare Ergebnisse zeigten sich in den britischen und europäischen Early Access-Programmen bei HCV Typ 3-induzierter dekompensierter Lebererkrankung nach 12-24 wöchiger Therapie mit SOF+DCV±RBV (jeweils 71%12 und 88%15). Für die Kombination von SOF+LDV±RBV wurden dagegen nur SVR-Raten von 63% (britisches EAP12) bzw. 42% (irisches EAP13) erzielt, so dass dieses Therapieregime für Patienten mit Genotyp 3 HCV-Infektion nicht mehr empfohlen wird (s. auch Tab. 4). Die hohe SVR-Rate von 88% im europäischen EAP kann teilweise auch dadurch erklärt werden, dass eine relativ hohe Anzahl von Patienten mit kompensierter Zirrhose eingeschlossen wurden und die Therapiedauer mehrheitlich 24 Wochen betrug, meist unter Einbeziehung von Ribavirin.15
Rolle von Ribavirin
Für die überwiegende Mehrzahl aller Patienten, auch solchen mit kompensierter Zirrhose, ist heutzutage eine Ribavirin-freie Therapie, bestehend aus zwei DAA, mit exzellenten Heilungschancen >95% realisierbar. Es existieren nur noch wenige Situationen, in welchen die Zugabe einer weiteren antiviral wirksamen Substanz, wie Ribavirin, notwendig ist. In Kürze wird in diesen Fällen eine Triple -DAA-Therapie zur Verfügung stehen – sofern keine Dekompensation vorliegt.
Die Mehrheit der Patienten mit dekompensierter Zirrhose wurde mit RBV-haltigen Regimen behandelt. In der ASTRAL-4-Studie lag die Gesamt-SVR-Rate in der Gruppe der 12-wöchigen RBV-haltigen Therapie mit 94% am höchsten.17 Interessanterweise hat eine alleinige Verlängerung der DAA-Therapie auf 24 Wochen keine wesentliche Steigerung der antiviralen Aktivität im Vergleich zur 12-wöchigen Therapie gezeigt. Dies betraf auch die Gruppe mit Genotyp 3-Infektion. Somit bleibt die zusätzliche Gabe von RBV bei diesem fortgeschrittenen Krankheitsbild auch bei der neuesten DAA-Kombination ein wichtiger Therapiebaustein, obwohl diese den Nachteil einiger Nebenwirkungen mit sich bringt. Im britischen Expanded Access-Programm zeigten sich unter Zugabe von RBV zwar numerisch höhere SVR-Raten, aber kein statistisch signifikanter Effekt auf das Therapieansprechen, obwohl nur ein kleiner Patientenanteil ohne RBV behandelt wurde.12 Die zusätzliche Ribavirin-Therapie ist vor allem bei Patienten mit dekompensierter Zirrhose und präexistenten Resistenz-assoziierten Varianten unverzichtbar.
Resistenzvarianten vor Therapie
Die
Relevanz natürlich vorkommender präexistenter
Resistenz-assoziierten HCV-Varianten (RAVs) für ein virologisches
Therapieversagen steigt signifikant an, wenn ein Patient weitere
Therapie-relevante Risikofaktoren mitbringt. Es ist daher nicht
verwunderlich, dass die Bedeutung der RAVs gerade bei Patienten mit
dekompensierter Zirrhose und HCV-Genotyp 3-Infektion am
eindrücklichsten ist. Von besonderer Bedeutung sind hierbei für die
eingesetzten DAA spezifische hoch resistente RAVs (>100- mal
Veränderung in EC50).
Für die Kombinationstherapie SOF/Velpatasvir hatte das Vorhandensein
präexistenter NS5A-RAVs bei Patienten ohne fortgeschrittene
Lebererkrankung keine wesentliche
Auswirkung auf die
SVR12-Raten.19
Allerdings war die Präsenz präexistenter NS5A-RAVs und insbesondere
der Y93H-RAV bei Patienten mit Genotyp 2 oder 3 mit etwas niedrigeren
SVR12-Raten assoziiert (97% versus 88%, für Y93H 84%).20
Für die Y93H-RAV wurden besonders niedrige SVR-Raten bei Patienten
mit HCV-Genotyp 3 und Leberzirrhose verzeichnet (Tab. 3). In der
ASTRAL-4 Studie für Patienten mit dekompensierter Leberzirrhose
zeigten sich in der RBV-freien Kohorte ebenfalls niedrigere SVR-Raten
von 80% bzw. 90%, wenn eine NS5A-RAV vorhanden war.17
Eine Untersuchung auf präexistente HCV-Resistenzvarianten sollte
daher bei Patienten mit ungünstigen prädiktiven Faktoren, wie
fortgeschrittene Leberzirrhose, HCV-Genotyp 3-Infektion und
therapieerfahrenen Patienten, erwogen werden, da abhängig vom
Ergebnis über die Zugabe von RBV oder eine Therapieverlängerung
entschieden werden kann.
Empfehlungen inkl. Warteliste
Im Juli 2016 wurden aktuelle Empfehlungen zur antiviralen Therapie der chronischen Hepatitis C bei Patienten auf der Warteliste publiziert.21 Das Regime aus Velpatasvir und SOF war zu diesem Zeitpunkt noch nicht zugelassen und wurde daher nicht berücksichtigt. Die Tabelle 3 zeigt zusammenfassend die aktuellen Empfehlungen zur antiviralen Therapie der chronischen Hepatitis C bei dekompensierter Zirrhose unter Einbezug von SOF/Velpatasvir.
In den EASL-Leitlinien von 2016 wird insbesondere für die HCV-Infektion mit dem Genotyp 3 eine 24 wöchige RBV-haltige Therapie mit SOF und Daclatasvir oder Velpatasvir empfohlen. Für die anderen Genotypen wird jeweils eine Therapiedauer von 12 Wochen mit der Zugabe von RBV empfohlen. SOF/LDV wird für Genotyp 2 nicht empfohlen (siehe auch Tab. 4).
Sicherheit
Für Patienten mit dekompensierter Zirrhose zeigt sich sowohl in den randomisierten Studien als auch in den Kohortenstudien für die Sofobuvir plus NS5A-Inhibitor-basierten Therapieregime ein vergleichbares Nebenwirkungsprofil wie bei Patienten ohne Zirrhose. Für die insgesamt gute Verträglichkeit dieser Therapie auch in fortgeschrittenen Erkrankungsstadien spricht auch die Tatsache, dass die Rate der Nebenwirkungs-assoziierten Therapieabbrüche in aktuellen Phase-3-Studien unter 5% lagen (siehe ASTRAL-4).17 Jedoch fehlen bisher kontrollierten Daten zum Nebenwirkungsprofil bei dekompensierter Zirrhose, da eine Placebotherapie in diesem Stadium der Erkrankung ethisch kaum zu rechtfertigen wäre. Aufgrund der bisherigen Unterrepräsentation von Patienten mit weit fortgeschrittener Dekompensation (MELD >15-20) in den aktuellen Studien und auch der Tatsache, dass Patienten mit koexistenter Nierenfunktionsstörung nicht in die Studien eingeschlossen wurden, kann das Sicherheitsprofil der DAA-Therapie in dieser Konstellation noch nicht abschließend beurteilt werden.
Es soll darauf hingewiesen werden, dass die Sterblichkeit unter Therapie in Abhängigkeit von den Kohorten und Child-Pugh-Stadium bei ca. 2-20%12,13,15 lag. Wenngleich mehrheitlich die Todesfälle der Schwere der Grunderkrankung zugeschrieben wurden, so sind im Einzelfall Therapie-assoziierte Faktoren nicht auszuschließen. So sind nach der Zulassung und breiten Anwendung dieser Substanzen einige Fallberichte und kleiner Kohorten publiziert worden, die auf eine mögliche Hepatoxizität der DAA-Therapie im Stadium der fortgeschrittenen Leberzirrhose hindeuten. So wurden Fälle mit ikterischer Dekompensation einer bereits fortgeschrittenen Leberzirrhose unter einer Kombinationstherapie aus SOF, NS5A-Inhibitor ± RBV beschrieben.23,24 Episoden von Laktatazidosen unter einer SOF-basierten Behandlung traten hauptsächlich bei Patienten mit zusätzlich eingeschränkter Nierenfunktion und einem höheren Child-Pugh- oder MELD-Score (mittlerer Score 21 vs. 10) auf und gingen auch teilweise mit infektiösen Komplikationen einher.25
Die DAA-Therapie sollte daher bei Patienten mit fortgeschrittener Zirrhose nur in erfahrenen Zentren und unter besonderer Vorsicht und engmaschigem Monitoring erfolgen.
Point of no return
Die Ausheilung der chronischen HCV-Infektion ist nicht zwangsläufig auch mit einer Heilung der Krankheitsfolgen assoziiert. Besonders deutlich wird das bei der Therapie von Patienten, bei denen die Erkrankung bereits das Stadium der Dekompensation erreicht hat. Es stellt sich daher die Frage, ab welchem Krankheitsstadium nicht mehr mit einer Rekompensation zu rechnen ist. Ebenso ist es relevant zu untersuchen, wie die Langzeitprognose der Patienten ist, bei denen es durch die Therapie zu einer Rekompensation gekommen ist. Zu all diesen Fragen gibt es bisher nur begrenzte Evidenz.
Eine Verbesserung des MELD- und Child-Pugh-Scores nach erfolgreicher antiviraler Therapie zeigte sich bei der Mehrheit der Patienten in der SOLAR-2- und ALLY-1-Studie.11,14 Allerdings war bei einigen Patienten auch eine Verschlechterung des MELD-Scores bzw. des Child-Pugh-Stadiums zu beobachten (Abb. 3). Ebenfalls wurde in der ASTRAL-4-Studie bei 81% der Patienten mit einem MELD-Score ≥15 eine Verbesserung des MELD-Scores beobachtet, wobei 7% eine Verschlechterung aufwiesen17 (Abb. 4). Im australischen Compassionate Use Program (Kombinationstherapie mit SOF und DCV für 24 Wochen ohne RBV) konnte eine Besserung der Leberfunktion im Sinne von einem Abfall des MELD-Scores ≥2 Punkte nur bei Patienten mit einem initialen MELD-Score <20 beobachtet werden.26 Ähnliche Ergebnisse wurden auch aus dem britischen Expanded Access-Programm berichtet: Patienten mit einem Albuminwert <35 g/L, Alter >65 Jahre oder niedriger Natriumkonzentration (<135 mmol/L) vor Therapiebeginn profitierten am Wenigsten von der Therapie.12 Außerdem wurde eine Verbesserung der portalen Hypertension bei Patienten mit Leberzirrhose im Stadium Child-Pugh A-C nach SVR berichtet, wobei in der univariaten Analyse ein MELD-Score <10 der einzige signifikante Faktor für einen Abfall des hepatovenösen Druckgradients (HVPG) um ≥20% war27 und Child B-Stadium seltener mit einem HVPG-Abfall assoziiert war.28
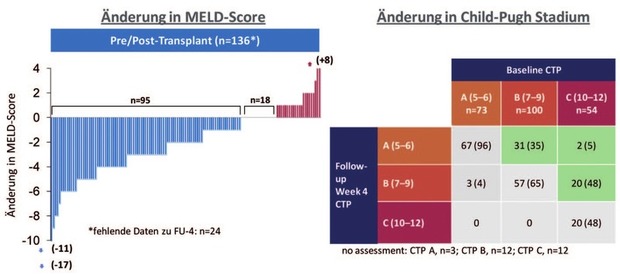
Abb. 3 SOLAR-2-Studie – Änderung in MELD-Score und Child-Pugh-Stadium zu Follow-up Woche 4 (FU-4). Die meisten Patienten zeigten eine Verbesserung des MELD-Scores bzw. des Child-Pugh-Stadiums
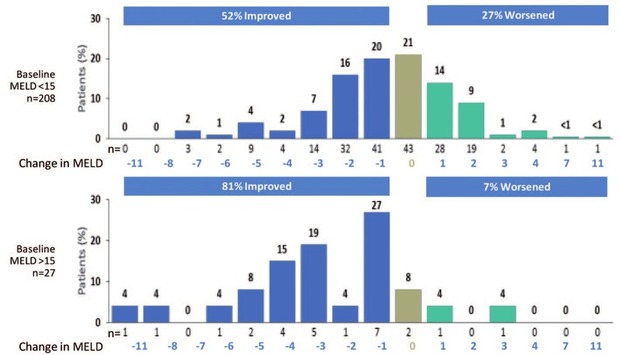
Abb. 4 ASTRAL-4-Studie – Änderung in MELD-Score zu Follow-up Woche 12
Insgesamt scheint es bei dekompensierter Leberzirrhose einen Punkt im Verlauf der Krankheit zu geben („Point of no return“), ab welchem auch nach erfolgreicher Viruseradikation kaum ein Prognose-relevanter Vorteil für die Patienten zu erwarten ist. Außerdem betreffen die vorliegenden Daten Untersuchungen unmittelbar nach Therapieende (Follow-up Woche 4 oder 12), so dass der längerfristige Verlauf nach SVR ebenfalls unklar ist.
Chance auf „De-Listung“?
Von besonderer Bedeutung ist die Prognose nach SVR bei Patienten, welche aufgrund einer dekompensierten HCV-Zirrhose für eine Lebertransplantation (LTx) bereits gelistet sind. Derzeit existieren keine ausreichenden Daten für eine eindeutige Empfehlung bezüglich des richtigen Zeitpunktes für die Durchführung einer antiviralen Therapie (Abb. 5). Idealerweise wäre eine Viruseradikation schon vor LTx zu erreichen, da hierdurch eine Reinfektion des Transplantats verhindert werden kann. Da inzwischen jedoch auch mit hoher Sicherheit und Effektivität nach der Transplantation das HCV-Rezidiv behandelt werden kann, ist die Dringlichkeit zur Therapie auf der Warteliste eigentlich nur dann gegeben, wenn erhofft werden kann, dass im Rahmen der Viruseradikation sich der Zustand des Patienten so verbessert, dass auch auf die Transplantation verzichtet werden kann. Es zeigt sich in aktuellen retrospektiven Kohortenstudien, dass nur in einigen Fällen nach SVR eine Abmeldung von der LTx-Liste aufgrund einer klinischen und laborchemischen Verbesserung der Leberfunktion (De-Listung) erfolgen kann. In der französischen Kohorte betrug die Rate der Abmeldungen von der Warteliste 16%29 und in einer weiteren europäischen Multizenter-Studie 19,2%30. Unabhängige prädiktiven Faktoren für die Chance einer Abmeldung von der Warteliste waren der initiale MELD-Score (≤20 vs >20 Punkte) sowie die Verbesserung von MELD-Score und Albumin zu Follow-up Woche 12 (Abb. 6).30
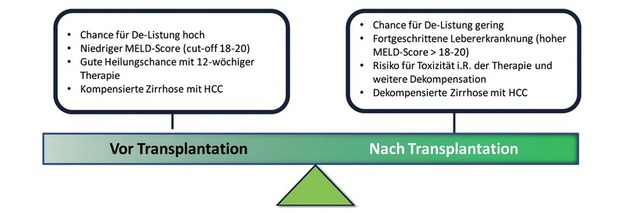
Abb. 5 Wichtige Faktoren für die Bestimmung des richtigen Therapiezeitpunktes bei Patienten mit dekompensierter Leberzirrhose auf der Warteliste
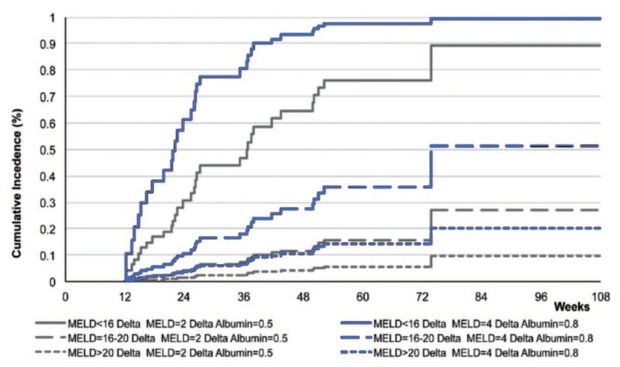
Abb. 6 Kumulative Inzidenz der Abmeldung von der LTx-Liste abhängig von MELD-Score und Änderung in MELD-Score und Albumin zu Follow-up Woche 12 30
Die Autoren empfehlen eine Therapie auf der Warteliste bei MELD <16, ein individuelles Vorgehen bei MELD 16-20 und keine Therapie bei MELD >20. Die deutsche Expertengruppe empfiehlt die Therapie bei MELD <18 und in den aktuellen EASL-Leitlinien wird bei einem MELD-Score ≥18-20 eine Therapie erst nach Transplantation empfohlen, es sei denn, die erwartete Wartezeit auf der Warteliste ist >6 Monate.
HCC-Risiko nach SVR
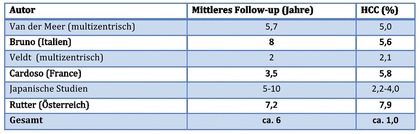
Tab. 5 HCC-Risiko nach SVR auf eine Interferon-basierte Therapie (modifiziert nach D’Abdrosio et al. 31 )
Das Risiko der HCC-Entwicklung bleibt bei Patienten mit fortgeschrittener Fibrose bzw. Zirrhose auch nach SVR bestehen und ist wahrscheinlich umso höher, je fortgeschrittener das Zirrhosestadium zum Zeitpunkt der antiviralen Therapie ist (in Analogie zu den Befunden bei der chronischen HBV-Infektion). Das jährliche HCC-Risiko nach SVR auf eine Interferon-basierte Therapie beträgt ca. 1%31 (Tab. 5).
Eine portugiesische Arbeitsgruppe berichtete eine HCC-Inzidenz von 7,4% im ersten Jahr bei 54 Patienten mit Leberzirrhose, die eine erfolgreiche DAA-Therapie erhielten. Diese Rate war höher im Vergleich zu den berichteten Daten aus Untersuchungen bei Patienten, die mit Interferon-haltiger Therapie behandelt wurden (1,2-1,4%).32 Obwohl Selektionsfehler bei dem retrospektiven Charakter der Studie möglich sind, kommentierten die Autoren, dass alle eingeschlossenen Patienten keine Kontraindikation für eine Interferontherapie hätten.
Eine retrospektiven Studie aus Spanien zeigte eine unerwartet hohe Rezidivrate (27,6% nach einem medianen Follow-up von 5,7 Monaten nach Beginn der DAA-Therapie) bei 58 Patienten, welche vorher eine Behandlung ihres HCC mit bestätigter kompletter Response erhalten und im Verlauf unter einer interferon-freien Therapie eine SVR erreicht hatten.33 Ähnliche Ergebnisse wie diese von Reig et al. zeigte auch eine zweite retrospektive Studie aus Italien bei 59 Patienten mit HCC in Remission mit einer Rezidivrate von 29%.34 Diese Ergebnisse konnten allerdings bei der Datenanalyse aus 3 prospektiven französischen Kohortenstudien nicht bestätigt werden.35 Hier konnte kein erhöhtes Risiko für HCC-Rezidiv nach DAA-Therapie im Vergleich zu den unbehandelten Patienten beobachtet werden.
Eine mögliche Erklärung für die beobachteten hohen HCC-Rezidivraten innerhalb von kurzer Zeit nach HCC-Behandlung und DAA-Therapie könnte eine inkomplette Response auf die HCC-Therapie oder ein inadäquates Tumorstaging sein. Diese Daten sollten in größeren Studien bestätigt werden, bevor sichere Schlussfolgerungen gezogen werden können, zumal diskrepante Ergebnisse aus den verschiedenen Arbeiten vorliegen.
Inzwischen wurden erste Daten zum HCC-Risiko nach DAA-induzierter SVR bei Patienten mit dekompensierter Zirrhose aus dem englischen EAP berichtet.36 In dieser retrospektiven Kohortenstudie zeigte sich in den ersten 6 Monaten nach Therapiebeginn sowohl im Vergleich zu den unbehandelten Patienten keine erhöhte HCC-Inzidenz (jeweils 4%). Im weiteren Verlauf nach SVR (Monat 6-15 nach Therapiebeginn) betrug die HCC-Inzidenz 2,5%.
Zusammenfassung
Patienten mit dekompensierter Zirrhose profitieren von einer DAA-Therapie, auch wenn die SVR-Raten mit ca. 85-90% im Vergleich zu Patienten im nicht-dekompensierten Stadium etwas geringer liegen. Therapiestandard ist die Kombination eines NS5A-Inhibitors mit Sofosbuvir plus Ribavirin für 12 Wochen. Eine Verlängerung der Therapiedauer kann bei Kontraindikationen gegenüber Ribavirin bzw. bei Nachweis einer NS5A-Resistenz erwogen werden. ProteaseInhibitoren sind bei Dekompensation kontraindiziert. In der Mehrzahl der Fälle kommt es bereits unter Therapie und im Verlauf nach SVR zu einer Stabilisierung der Erkrankung bzw. Verbesserung der Leberfunktion mit einer Reduktion des Risikos für weitere akute Dekompensationen. Die Wahrscheinlichkeit einer Verbesserung der langfristigen Prognose ist jedoch vom Stadium der Erkrankung abhängig. Bei Child-C-Zirrhose bzw. einem MELD-Score von >20 ist die Wahrscheinlichkeit einer langfristigen Verbesserung unwahrscheinlich. Auch nimmt das potentielle Risiko für DILI zu, insbesondere wenn die Patienten zusätzlich Einschränkungen der Nierenfunktion zeigen. In diesem Stadium ist eine individuelle Therapieentscheidung zu treffen. Die Therapie der dekompensierten Zirrhose gehört daher in die Hände von Spezialisten und sollte idealerweise in Abstimmung mit einem Transplantationszentrum erfolgen.
Literatur
1 Lens S, Gambato M, Londono MC, Forns X. Interferon-free regimens in the liver-transplant setting. Seminars in liver disease 2014; 34(1): 58-71.
2 Smolders EJ, de Kanter CT, van Hoek B, Arends JE, Drenth JP, Burger DM. Pharmacokinetics, Efficacy, and Safety of Hepatitis C Virus Drugs in Patients with Liver and/or Renal Impairment. Drug safety 2016; 39(7): 589-611.
3 Khatri A, Menon RM, Marbury TC, et al. Pharmacokinetics and safety of co-administered paritaprevir plus ritonavir, ombitasvir, and dasabuvir in hepatic impairment. Journal of Hepatology; 63(4): 805-12.
4 Mantry PS, Hanson J, Trinh R, et al. Ombitasvir/Paritaprevir/r and Dasabuvir With Ribavirin for HCV Genotype 1 Patients With Decompensated Cirrhosis (Poster 722). Hepatology 2015.
5 Saxena V, Nyberg L, Pauly M, et al. Safety and Efficacy of Simeprevir/Sofosbuvir in Hepatitis C-In-fected Patients With Compensated and Decompen-sated Cirrhosis. Hepatology 2015; 62(3): 715-25.
6 Sulkowski MS, Vargas HE, Di Bisceglie AM, et al. Effectiveness of Simeprevir Plus Sofosbuvir, With or Without Ribavirin, in Real-World Patients With HCV Genotype 1 Infection. Gastroenterology 2016; 150(2): 419-29.
7 Lawitz E, Matusow G, DeJesus E, et al. Simeprevir plus sofosbuvir in patients with chronic hepatitis C virus genotype 1 infection and cirrhosis: A phase 3 study (OPTIMIST-2). Hepatology 2016;64(2):360-9.
8 Jacobson IM, Poordad F, Firpi-Morell R, et al. O008 : Efficacy and safety of grazoprevir and elbasvir in hepatitis C genotype 1-infected patients with child-pugh class B cirrhosis (C-salt part A). Journal of Hepatology; 62: S193-S4.
9 Mogalian E, Mathias A, Brainard D, et al. P742 THE PHARMACOKINETICS OF GS-5816, A PAN-GENOTYPIC HCV NS5A INHIBITOR, IN HCV-UNINFECTED SUBJECTS WITH MODERATE AND SEVERE HEPATIC IMPAIRMENT. Journal of Hepatology; 60(1): S317.
10 Charlton M, Everson GT, Flamm SL, et al. Ledipasvir and Sofosbuvir Plus Ribavirin for Treatment of HCV Infection in Patients With Advanced Liver Disease. Gastroenterology 2015; 149(3): 649-59.
11 Manns M, Samuel D, Gane EJ, et al. Ledipasvir and sofosbuvir plus ribavirin in patients with genotype 1 or 4 hepatitis C virus infection and advanced liver disease: a multicentre, open-label, randomised, phase 2 trial. The Lancet Infectious diseases 2016; 16(6): 685-97.
12 Foster GR, Irving WL, Cheung MC, et al. Impact of direct acting antiviral therapy in patients with chronic hepatitis C and decompensated cirrhosis. J Hepatol 2016; 64(6): 1224-31.
13 Gray E, O‘Leary A, Stewart S, et al. High mortality during direct acting antiviral therapy for hepatitis C patients with Child‘s C cirrhosis: Results of the Irish Early Access Programme. J Hepatol 2016; 65(2): 446-8.
14 Poordad F, Schiff ER, Vierling JM, et al. Daclatasvir with sofosbuvir and ribavirin for hepatitis C virus infection with advanced cirrhosis or post-liver transplantation recurrence. Hepatology 2016; 63(5): 1493-505.
15 Welzel TM, Petersen J, Herzer K, et al. Daclatasvir plus sofosbuvir, with or without ribavirin, achieved high sustained virological response rates in patients with HCV infection and advanced liver disease in a real-world cohort. Gut 2016.
16 Hezode C, De Ledinghen V, Fontaine H, et al. LP05 : Daclatasvir plus sofosbuvir with or without ribavirin in patients with HCV genotype 3 infection: Interim analysis of a french multicenter compassionate use program. Journal of Hepatology; 62: S265-S6.
17 Curry MP, O‘Leary JG, Bzowej N, et al. Sofosbuvir and Velpatasvir for HCV in Patients with Decompensated Cirrhosis. The New England journal of medicine 2015; 373(27): 2618-28.
18 Poordad F, Schiff ER, Vierling JM, et al. LO8 : Daclatasvir, sofosbuvir, and ribavirin combination for HCV patients with advanced cirrhosis or posttransplant recurrence: Phase 3 ALLY-1 study. Journal of Hepatology; 62: S261-S2.
19 Feld JJ, Jacobson IM, Hezode C, et al. Sofosbuvir and Velpatasvir for HCV Genotype 1, 2, 4, 5, and 6 Infection. The New England journal of medicine 2015; 373(27): 2599-607.
20 Foster GR, Afdhal N, Roberts SK, et al. Sofosbuvir and Velpatasvir for HCV Genotype 2 and 3 Infection. New England Journal of Medicine 2015; 373(27): 2608-17.
21 Zimmermann T, Beckebaum S, Berg C, et al. [Expert recommendations: Hepatitis C and transplantation]. Zeitschrift fur Gastroenterologie 2016; 54(7): 665-84.
22 EASL Recommendations on Treatment of Hepatitis C 2016. Journal of Hepatology.
23 Dyson JK, Hutchinson J, Harrison L, et al. Liver toxicity associated with sofosbuvir, an NS5A inhibitor and ribavirin use. J Hepatol 2016; 64(1): 234-8.
24 Marchan-Lopez A, Dominguez-Dominguez L, Kessler-Saiz P, Jarrin-Estupinan ME. Liver failure in human immunodeficiency virus - Hepatitis C virus coinfection treated with sofosbuvir, ledipasvir and antiretroviral therapy. J Hepatol 2016; 64(3): 752-3.
25 Welker MW, Luhne S, Lange CM, et al. Lactic acidosis in patients with hepatitis C virus cirrhosis and combined ribavirin/sofosbuvir treatment. J Hepatol 2016; 64(4): 790-9.
26 McCaughan G, Roberts S, Strasser S, et al. The TOSCAR Study: Sofosbuvir and Daclatasvir Therapy for Decompensated HCV Cirrhosis with MELD scores ≥ 15: What is the point of no return? Hepatology 2015.
27 Afdhal N, Everson GT, Calleja JL, et al. LP13 : Effect of long term viral suppression with sofosbuvir + ribavirin on hepatic venous pressure gradient in HCV-infected patients with cirrhosis and portal hypertension. Journal of Hepatology; 62: S269-S70.
28 Mandorfer M, Kozbial K, Schwabl P, et al. Sustained virologic response to interferon-free therapies ameliorates HCV-induced portal hypertension. J Hepatol 2016; 65(4): 692-9.
29 Coilly A, Pageaux G, Houssel-Debry P, et al. Improving liver function and delisting of patients awaiting liver transplantation for HCV cirrhosis: do we ask too much to DAAs? . Hepatology 2015.
30 Belli LS, Berenguer M, Cortesi PA, et al. Delisting of liver transplant candidates with chronic hepatitis C after viral eradication: A European study. J Hepatol 2016.
31 D‘Ambrosio R, Colombo M. Should surveillance for liver cancer be modified in hepatitis C patients after treatment-related cirrhosis regression? Liver Int 2016; 36(6): 783-90.
32 Cardoso H, Vale AM, Rodrigues S, et al. High incidence of hepatocellular carcinoma following successful interferon-free antiviral therapy for hepatitis C associated cirrhosis. J Hepatol 2016.
33 Reig M, Marino Z, Perello C, et al. Unexpected early tumor recurrence in patients with hepatitis C virus -related hepatocellular carcinoma undergoing inter-feron-free therapy: a note of caution. J Hepatol 2016.
34 Conti F, Buonfiglioli F, Scuteri A, et al. Early occurrence and recurrence of hepatocellular carcinoma in HCV-related cirrhosis treated with direct-acting antivirals. J Hepatol 2016; 65(4): 727-33.
35 Pol S. Lack of evidence of an effect of Direct Acting Antivirals on the recurrence of hepatocellular carcinoma: The ANRS collaborative study group on hepatocellular carcinoma (ANRS CO22 HEPATHER, CO12 CIRVIR and CO23 CUPILT cohorts). J Hepatol 2016.
36 Cheung MC, Walker AJ, Hudson BE, et al. Outcomes after successful direct-acting antiviral therapy for patients with chronic hepatitis C and decompensated cirrhosis. J Hepatol 2016; 65(4): 741-7.





