Fabienne Schumacher und Frank Tacke, Aachen
Die nicht-alkoholische Fettlebererkrankung (NAFLD)
Die rasant zunehmende Prävalenz von Adipositas und Typ 2 Diabetes, und damit auch des metabolischen Syndroms, stellt die Medizin – ob in Klinik oder Praxis – vor gewaltige Herausforderungen. Adipositas und/oder metabolisches Syndrom bedingen aber nicht nur kardiovaskuläre Risiken, sondern gehen auch mit einer erheblichen Morbidität und Letalität in Bezug auf Lebererkrankungen einher. Die hepatische Manifestation des metabolischen Syndroms ist die nicht-alkoholische Fettlebererkrankung (non-alcoholic fatty liver disease, NAFLD).
Die NAFLD ist ein Überbegriff für die Steatosis hepatis (Fettleber, d.h. Einlagerung von Fett in Hepatozyten), die nicht-alkoholische Steatohepatitis (NASH) und deren Folgeerkrankungen (NASH-Leberfibrose, NASH-Leberzirrhose, hepatozelluläres Karzinom). Für die Diagnose einer NAFLD müssen ein signifikanter Alkoholkonsum (d.h. weniger als 20 g Alkohol pro Tag bei Männern bzw. <10 g/d bei Frauen) und andere sekundäre Ursachen für die Leberverfettung (z.B. Hepatitis C Genotyp 3, Methotrexat, Sprue etc.) ausgeschlossen sein.1
Das Risiko für die Progression von einer Steatosis hepatis zur NASH und NASH-Zirrhose ist von unterschiedlichen Faktoren abhängig, zum Beispiel dem Lebensstil des Patienten, genetischen Faktoren, aber auch der Ausprägung des metabolischen Syndroms. So haben Patienten mit einem Typ 2 Diabetes bzw. einer Insulinresistenz und/oder Adipositas ein deutlich erhöhtes Risiko für die Progression der NAFLD.2
Progression zu NASH
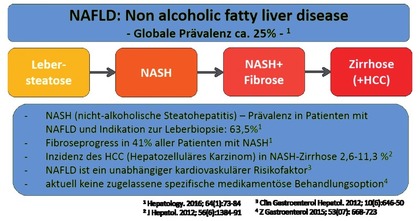
Abb. 1 Epidemiologie und natürlicher Verlauf der nicht-alkoholischen Fettlebererkrankung
Die NASH stellt die entzündliche, progrediente Form der NAFLD dar. Eine NASH kann nur durch eine Leberbiopsie eindeutig diagnostiziert werden3, weil sie durch eine Verfettung und Ballonierung der Hepatozyten sowie eine entzündliche Infiltration der Leber charakterisiert ist. Wichtige Pathomechanismen sind die Akkumulation von Fett in Hepatozyten, vermehrter oxidativer Stress, einhergehend mit einer entzündlichen Aktivierung von hepatischen Immunzellen (insbesondere Makrophagen) und der Infiltration von Entzündungszellen (insbesondere Monozyten) in die Leber sowie einer Degeneration der Hepatozyten.4 Durch diese Krankheitsprozesse wird die Entwicklung einer Leberfibrose (narbige Bindegewebsvermehrung) begünstigt und es besteht im Verlauf das Risiko eines Progresses zur Leberzirrhose und der Entwicklung eines hepatozellulären Karzinoms (HCC) (Abb. 1).
Epidemiologie
Global, aber auch in Deutschland beträgt die Prävalenz der Fettlebererkrankungen zwischen 20-30% der erwachsenen Bevölkerung. In einer aktuellen Meta- Analyse wird für Deutschland eine Zahl von 12 Millionen Betroffenen mit NAFLD angegeben, wobei >750.000 Menschen in Deutschland eine NASH aufweisen.5 Es wird angenommen, dass 41% aller NASH-Patienten einen Progress mit Leberfibrose entwickeln, wobei nicht alle Patienten das Vollbild einer Leberzirrhose ausbilden. Die Inzidenz für das HCC in der NASH-Leberzirrhose liegt zwischen 2,6-11,3%. Mittlerweile mehren sich die Hinweise, dass in der NASH auch bei geringer bis mäßiger Fibrose bereits ein erhöhtes HCC-Risiko vorliegt.6 Es wird erwartet, dass die NASH-Leberzirrhose aufgrund der stark zunehmenden Prävalenz bereits in den 2020er-Jahren die häufigste Indikation zur Lebertransplantation in den USA sein wird.7 Auch in Deutschland ist die NASH-Zirrhose oder das NASH-assoziierte HCC eine zunehmende Indikation zur Lebertransplantation.8 Diese Entwicklung unterstreicht, dass die NAFLD bereits in ihren frühen Krankheitsstadien in den Fokus rücken sollte, um NASH-assoziierte Folgeerkrankungen zu verhindern.
Multidisziplinarität
Patienten mit einer NAFLD haben eine erhöhte Gesamtmortalität, welche vor allem auf kardiovaskuläre Erkrankungen, Tumorerkrankungen und einen Progress der Lebererkrankung selbst zurückzuführen ist.9 Hier ist festzuhalten, dass kardiovaskuläre Erkrankungen in der NAFLD eine häufigere Todesursache sind, als Leber-bedingte Komplikationen. Die NAFLD gilt zudem als ein unabhängiger kardiovaskulärer Risikofaktor und ist ein Prädiktor für die Entwicklung eines Typ 2 Diabetes.9 Dies unterstreicht, dass die Betreuung von Patienten mit einer Fettlebererkrankung multi-disziplinär erfolgen sollte, um dem individuellen Risikoprofil der Patienten (kardiovaskuläre Erkrankungen, Tumorvorsorge, Diabetes, metabolische Störungen) und ihren Komorbiditäten gerecht zu werden. Konsequenterweise sollte die NAFLD nicht als isolierte Lebererkrankung, sondern als Teil einer Systemerkrankung betrachtet werden.
Prognoseabschätzung
Eine ausgeprägte Fettleber kann relativ einfach durch eine Ultraschalluntersuchung (hyperechogenes Lebergewebe) diagnostiziert werden. Eine Abschätzung der Prognose ist aber nur möglich, wenn das Risikoprofil des Patienten, das Grading der NAFLD (z.B. NASH) und das Staging (Fibrose-Grad) ermittelt werden. Für die Prognoseabschätzung der NASH ist das Vorhandensein einer Leberfibrose besonders relevant. Kann in der Leber-histologie eine Fibrose nachgewiesen werden, so geht dies mit einer signifikant höheren Letalität im Vergleich zur NAFLD-/NASH-Erkrankung ohne Leberfibrose einher. Inflammation und Steatoseausmaß haben hingegen keinen unmittelbaren Einfluss auf die Letalität.10
Wann Biopsie?
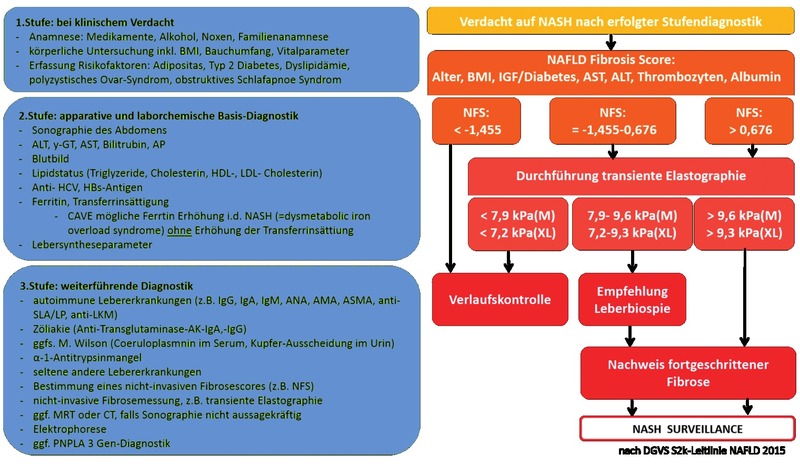
Obwohl die NASH oder NASH-Fibrose strenggenommen nur durch eine Leberbiopsie festgestellt werden können, erscheint es aufgrund der hohen Zahl an Betroffenen mit Fettleber unrealistisch, in allen Fällen eine bioptische Diagnosesicherung durchzuführen. Es muss vielmehr darum gehen, eine pragmatische Risikostratifizierung vorzunehmen und beispielsweise Patienten mit einem sehr niedrigen Risiko für eine Fibrose bereits nicht-invasiv zu erkennen (und dann nicht zu biopsieren). Die Leitlinie zur NAFLD der DGVS empfiehlt zur diagnostischen Aufarbeitung einen Algorithmus, welcher in Abbildung 2 zusammengefasst ist.1 Es werden dann nur Patienten mit unklarem Befund oder bei therapeutischer Relevanz (z.B. vor Einschluss in Studien oder zum Ausschluss einer anderen Lebererkrankung) einer Leberbiopsie unterzogen.
Basis-Diagnostik
Wichtig ist, dass nicht nur Hepatologen (und Gastroenterologen, Infektiologen) an die NAFLD denken. Grundsätzlich sollten alle Patienten mit metabolischem Syndrom zumindest einmalig eine Untersuchung der Leberwerte (y-GT, ALT, AST) und eine Sonographie zum Ausschluss einer Lebersteatose erhalten.3 Des Weiteren sollten alle Patienten mit erhöhten Leberwerten auf eine NAFLD untersucht werden, da dies die häufigste Ursache für inzidentell nachgewiesene erhöhte Leberwerte ist. Vorangehend sollten der Ausschluss anderer Lebererkrankungen und eine Bildgebung der Leber erfolgen. Hier ist vor allem eine Sonographie der Leber zu empfehlen, da sie besonders aussagekräftig in der Diagnostik einer moderaten und schweren Leberverfettung ist.1 Auch für die Durchführung einer MRS-PDFF-Untersuchung (MRT-Analyse zur Lebersteatose) gibt es gut validierte Daten, diese Untersuchung ist jedoch noch kein Teil der klinischen Routine und im Vergleich zum Ultraschall nicht so breit verfügbar, teurer und aufwändiger.11
NAFLD Fibrosis Score
Im Algorithmus der deutschen Leitlinie1 wird auf Basis des NFS-Scores (NAFLD Fibrosis Score, http://nafldscore.com/) und einer Leberelastographie die Entscheidung zur Leberbiopsie getroffen (Abb. 2). Der NFS-Score umfasst Alter, BMI, Leberwerte, Thrombozyten, Albumin und das Vorliegen eines Prä-/Diabetes. Die europäische Leitlinie fasst die Indikation zur Leberbiopsie deutlich offener, denn zur definitiven Diagnosesicherung der NASH ist der histologische Nachweis einer Verfettung >5%, der Nachweis von Hepatozyten-Ballonierung („Ballooning“) und einer Entzündung in der Leberbiopsie erforderlich.3 Für die Erfassung dieser drei Kriterien gibt es keine Alternative zur Leberbiopsie. Die Leberenzyme korrelieren nicht gut mit der Stärke der Entzündung oder dem Verlauf der Erkrankung und sind damit auch in der Verlaufskontrolle nur eingeschränkt zu verwerten. Ebenso gelingt die definitive Festlegung des Fibrosegrades nur in der Leberbiopsie. Der NFS-Score ist nicht gut zur genaueren Differenzierung bei gering bis mäßiggradiger Fibrose (F0/F1/F2) geeignet. Die Leberelastographie ist limitiert bei der Beurteilung besonders übergewichtiger Patienten (bis zu 20% aller Untersuchungen sind nicht verwertbar).12
Die DGVS-Leitlinie empfiehlt ebenfalls keine Leberbiopsie bei (klinisch) gesicherter Leberzirrhose.1 Diese Empfehlung berücksichtigt das höhere peri-interventionelle Risiko der Biopsie und die schwierigere Befundung, weil es bei fortgeschrittener Leberzirrhose auf dem Boden einer NASH häufig zu einem Verlust der Leberverfettung kommen kann. Eine kryptogene Leberzirrhose kann auch dann leitliniengerecht einer NASH zugeordnet werden, wenn andere Risikofaktoren und Lebererkrankungen ausgeschlossen wurden und ein oder mehrere metabolische Risikofaktoren vorliegen (Adipositas, Typ 2 Diabetes, Dyslipidämie).1
Progression
Neben dem Vorliegen von Adipositas, Dyslipidämie und einer bestehenden Insulinresistenz spielen auch genetische Veränderungen eine Rolle für den Progress der NAFLD. Ein identifizierter genetischer Faktor ist der Polymorphismus im PNPLA3 Gen. Bei einem homozygoten Nachweis des Polymorphismus besteht ein deutlich erhöhtes Risiko zur Entwicklung einer Leberverfettung, einer Fibrose mit Fortschreiten zur Leberzirrhose und ein erhöhtes HCC-Risiko. Die genetische Diagnostik wird von den aktuellen Leitlinien bislang noch nicht als Standard gefordert, kann aber helfen, das individuelle Risiko eines Patienten abzuschätzen.1, 3
Aufgrund der Assoziation der Erkrankungen sollten alle Patienten mit NAFLD/NASH eine Basisdiagnostik zur Abschätzung des kardiovaskulären Risikos und zum metabolischen Syndrom erhalten (Abb. 2). Ein manifester Diabetes sollte mittels HbA1c ausgeschlossen werden, ggf. hilft der HOMA-IR zur Einschätzung der Insulinresistenz .3
Therapie
Es gibt aktuell keine für die NASH oder NAFLD zugelassene spezifische medikamentöse Therapie.1, 3 Daher bleiben als Grundpfeiler der aktuellen Therapie die Anpassung des Lebensstils sowie die Kontrolle und Therapie des metabolischen Syndroms, insbesondere eine Behandlung der kardiovaskulären Risikofaktoren. Lebensstil-Interventionen sind nachgewiesenermaßen effektiv. Bei adipösen Patienten ist bereits eine Gewichtsreduktion von 10% innerhalb eines Jahres ausreichend, um NAS-Score und Fibrose-Stadium signifikant zu senken. Allerdings erreichen auch unter streng kontrollierten Studienbedingungen nur etwa 10% der Patienten den empfohlen Gewichtsverlust von 10% in einem Jahr.13
Gewichtsreduktion

Abb. 3 Empfehlungen zu Lebensstiländerungen bei Fettlebererkrankungen
Eine Übersicht über die empfohlenen Lebensstilmodifikationen gibt die Abbildung 3. Eine bestehende Dyslipidämie und eine arterielle Hypertonie sollten entsprechend der Empfehlung der kardiologischen Fachgesellschaften behandelt werden. Da die Fettlebererkrankung ein unabhängiger kardiovaskulärer Risikofaktor ist, sind in der Bewertung möglicher Interventionen und Therapien die kardiovaskulären Endpunkte relevant. Deswegen sind zur Behandlung der Erkrankungen des metabolischen Syndroms auch bei NAFLD-Patienten Medikamente zu bevorzugen, die einen günstigen kardiovaskulären Effekt gezeigt haben.
Antidiabetika
Bei dem Vorliegen eines Typ 2 Diabetes ist daher der frühzeitige Einsatz von GLP-1 Agonisten zu bedenken: In Studien konnten für Liraglutid und Semaglutid ein kardiovaskulärer Nutzen nachgewiesen werden.14, 15 Zudem konnte für Liraglutid in der LEAN-Studie (Phase-II-Studie zur Evaluation von Liraglutid in 52 adipösen NASH Patienten) auch eine signifikante histologische Verbesserung der NASH ohne Fibroseprogress nachgewiesen werden. Diese Wirkungen sind wahrscheinlich auf den durch Liraglutid bedingten Gewichtsverlust zurückzuführen.16 Liraglutid ist zur Therapie des Typ 2 Diabetes (in Kombination mit Metformin) in Deutschland zugelassen. Der alternative GLP1-Agonist Semaglutid, welcher nur einmal wöchentlich s.c. appliziert werden muss, wird derzeit in einer Phase-II-Studie bei NASH-Patienten erprobt. Ein weiteres Diabetesmedikament mit eindrücklichem Nachweis eines verbesserten kardiovaskulärem Risikoprofils ist Empagliflozin, ein SGLT-2-Inhibitor.17 Daten zu einem möglichen Effekt in der NAFLD liegen allerdings noch nicht vor.
Metformin hat keinen direkten Effekt auf die Lebersteatose, ist aber Mittel der 1.Wahl beim Typ 2 Diabetes. Metformin hat wahrscheinlich einen positiven Effekt auf die HCC-Entwicklung, wobei reduzierte HCC-Raten unter Metformin-Therapie bisher nur in retrospektiven Studien nachgewiesen werden konnten.18 Ein Verfahren mit sehr positiven Effekten sowohl auf NASH als auch auf Diabetes und metabolisches Syndrom ist die bariatrische Chirurgie.3 Bariatrische Verfahren können typischerweise bei Patienten ab einem BMI ≥35 erwogen werden.
Neue Medikamente
Derzeit befinden sich zahlreiche neue medikamentöse Therapieansätze in fortgeschrittenen Phasen der klinischen Prüfung (eine Auswahl zeigt Abb. 4). Die Medikamente unterscheiden sich in ihren Ansatzpunkten innerhalb der Lebererkrankung. So gibt es vielversprechende Hinweise, dass mittels PPAR-Agonisten (z.B. IVA-337 oder Elafibranor) die gestörte Stoffwechselsituation beeinflusst werden kann. Hier hat der GOLDEN-Trial, die Phase-II-Studie zu Elafibranor, günstige Ergebnisse zur Verbesserung der NASH-Aktivität, des kardiovaskulären Risikos und der diabetogenen Stoffwechsellage gezeigt.19
Einen anderen Wirkmechanismus weist das Gallensäure-Analogon Obeticholsäure auf, das im letzten Jahr zur Behandlung der PBC zugelassen wurde. Obeticholsäure fungiert als Agonist des Farnesoid X Rezeptors (FXR), und in einer Phase-II-Studie (FLINT-Studie) konnte ein positiver Effekt auf die Leberfibrose in Patienten mit NASH nachgewiesen werden.20 Das zweite Medikament mit dem Nachweis einer signifikanten Verbesserung der Leberfibrose ist der Chemokinrezeptor CCR2/CCR5-Hemmer Cenicriviroc, welcher die Infiltration von Makrophagen in die Leber hemmt.21 In der noch nicht voll publizierten Phase- II-Studie (CENTAUR) zeigte bereits nach einem Jahr ein höherer Anteil der mit Cenicriviroc behandelten Patienten eine Verbesserung der Leberfibrose. Ein Signal antifibrotischer Wirksamkeit in einer Phase-II-Studie zeigte auch die Substanz Selonsertib, welche das Entzündungs-assoziierte Signalmolekül ASK-1 in verschiedenen Leberzellen (Hepatozyten, Makrophagen, Sternzellen) inhibiert.
Obeticholsäure,
Elafibranor, Cenicriviroc und Selonsertib werden derzeit in
Zulassungsstudien („Phase III“) geprüft, an denen zahlreiche
Zentren in ganz Deutschland beteiligt sind.
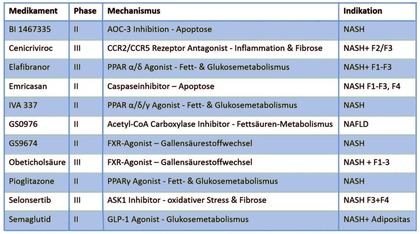
Abb. 4 Auswahl vielversprechender Substanzen in klinischen Studien
Eine Übersicht über wichtige Substanzen und laufende Studien bietet die Abb. 4. Diese Studien unterscheiden sich zum Teil deutlich im Studiendesign und schließen unterschiedliche Patientengruppen bezüglich des Stadiums der Erkrankung (Fettleber, NASH mit und ohne Fibrose, NASH-Leberzirrhose) und Begleiterkrankungen (z.B. Adipositas, Diabetes, metabolisches Syndrom) ein. Aufgrund der Vielzahl der derzeit laufenden Studien ist es sehr ratsam, „Risikopatienten“ in einem hepatologischen Zentrum vorzustellen. Patienten, die möglicherweise besonders von einem Studieneinschluss profitieren können, sind schlanke NASH-Patienten, NASH-Patienten mit einer fortgeschrittenen Leberfibrose oder NASH-Patienten, die nicht auf eine Lebensstilanpassung ansprechen oder diese nicht umsetzen können.
Trotz der Vielzahl laufender Studien wird mit den ersten Zulassungen von Medikamenten zur Therapie der NASH in Europa erst in 2-3 Jahren gerechnet. Es wird wahrscheinlich noch länger dauern, bis effektive Kombinationstherapien verschiedener Präparate verfügbar sein werden, die über verschiedene Wirkmechanismen die komplexen Prozesse innerhalb der Systemerkrankung NASH kontrollieren können.
Zusammenfassung
In der Zusammenschau der vorliegenden Daten kann man festhalten, dass die NAFLD und insbesondere die NASH klinisch relevante Krankheitsbilder sind, die einer strukturierten Diagnose und Kontrolle sowie einer effektiven Intervention bedürfen. Grundpfeiler der Behandlung sind Lebensstiländerungen (Gewichtsverlust und -normalisierung, Ernährungsumstellung, körperliche Aktivität) und Kontrolle der metabolischen Risikofaktoren (Diabetes, Dyslipidämie, Insulinresistenz). Zahlreiche vielversprechende neue medikamentöse Therapieansätze sind derzeit in der klinischen Prüfung. Nach Möglichkeit sollten NASH-Patienten mit hohem Risiko, insbesondere mit bereits fortgeschrittener Fibrose, in die aktuell laufenden Studien eingeschlossen werden.
Literatur
1 Roeb E, Steffen HM, Bantel H, Baumann U, Canbay A, Demir M, et al. [S2k Guideline non-alcoholic fatty liver disease]. Zeitschrift fur Gastroenterologie 2015;53(7): 668-723.
2 Yki-Jarvinen H. Non-alcoholic fatty liver disease as a cause and a consequence of metabolic syndrome. The lancet Diabetes & endocrinology 2014;2(11): 901-910.
3 European Association for the Study of the Liver. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. Journal of hepatology 2016;64(6): 1388-1402.
4 Heymann F, Tacke F. Immunology in the liver-from homeostasis to disease. Nature reviews Gastroenterology & hepatology 2016;13(2): 88-110.
5 Younossi ZM, Blissett D, Blissett R, Henry L, Stepanova M, Younossi Y, et al. The economic and clinical burden of nonalcoholic fatty liver disease in the United States and Europe. Hepatology 2016;64(5): 1577-1586.
6 Zoller H, Tilg H. Nonalcoholic fatty liver disease and hepatocellular carcinoma. Metabolism: clinical and experimental 2016;65(8): 1151-1160.
7 Goldberg D, Ditah IC, Saeian K, Lalehzari M, Aronsohn A, Gorospe EC, et al. Changes in the Prevalence of Hepatitis C Virus Infection, Nonalcoholic Steatohepatitis, and Alcoholic Liver Disease Among Patients With Cirrhosis or Liver Failure on the Waitlist for Liver Transplantation. Gastroenterology 2017;152(5): 1090-1099 e1091.
8 Tacke F, Kroy DC, Barreiros AP, Neumann UP. Liver transplantation in Germany. Liver transplantation: official publication of the American Association for the Study of Liver Diseases and the International Liver Transplantation Society 2016;22(8): 1136-1142.
9 Adams LA, Anstee QM, Tilg H, Targher G. Non-alcoholic fatty liver disease and its relationship with cardiovascular disease and other extrahepatic dis-eases. Gut 2017;66(6): 1138-1153.
10 Angulo P, Kleiner DE, Dam-Larsen S, Adams LA, Bjornsson ES, Charatcharoenwitthaya P, et al. Liver Fibrosis, but No Other Histologic Features, Is Associated With Long-term Outcomes of Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology 2015;149(2): 389-397 e310.
11 Wilman HR, Kelly M, Garratt S, Matthews PM, Milanesi M, Herlihy A, et al. Characterisation of liver fat in the UK Biobank cohort. PloS one 2017;12(2): e0172921.
12 European Association for Study of Liver. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. Journal of hepatology 2015;63(1): 237-264.
13 Vilar-Gomez E, Martinez-Perez Y, Calzadilla-Bertot L, Torres-Gonzalez A, Gra-Oramas B, Gonzalez-Fabian L, et al. Weight Loss Through Lifestyle Modification Significantly Reduces Features of Nonalcoholic Steatohepatitis. Gastroenterology 2015;149(2): 367-378 e365; quiz e314-365.
14 Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jodar E, Leiter LA, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. The New England journal of medicine 2016;375(19): 1834-1844.
15 Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JF, Nauck MA, et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. The New England journal of medicine 2016;375(4): 311-322.
16 Armstrong MJ, Gaunt P, Aithal GP, Barton D, Hull D, Parker R, et al. Liraglutide safety and efficacy in patients with non-alcoholic steatohepatitis (LEAN): a multicentre, double-blind, randomised, placebo-controlled phase 2 study. Lancet 2016;387(10019): 679-690.
17 Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. The New England journal of medicine 2015;373(22): 2117-2128.
18 Zhang ZJ, Zheng ZJ, Shi R, Su Q, Jiang Q, Kip KE. Metformin for liver cancer prevention in patients with type 2 diabetes: a systematic review and meta-analysis. The Journal of clinical endocrinology and metabolism 2012;97(7): 2347-2353.
19 Ratziu V, Harrison SA, Francque S, Bedossa P, Lehert P, Serfaty L, et al. Elafibranor, an Agonist of the Peroxisome Proliferator-Activated Receptor-alpha and -delta, Induces Resolution of Nonalcoholic Steatohepatitis Without Fibrosis Worsening. Gastroenterology 2016;150(5): 1147-1159 e1145.
20 Neuschwander-Tetri BA, Loomba R, Sanyal AJ, Lavine JE, Van Natta ML, Abdelmalek MF, et al. Farnesoid X nuclear receptor ligand obeticholic acid for non-cirrhotic, non-alcoholic steatohepatitis (FLINT): a multicentre, randomised, placebo-controlled trial. Lancet 2015;385(9972): 956-965.
21 Friedman S, Sanyal A, Goodman Z, Lefebvre E, Gottwald M, Fischer L, et al. Efficacy and safety study of cenicriviroc for the treatment of non-alcoholic steatohepatitis in adult subjects with liver fibrosis: CENTAUR Phase 2b study design. Contemporary clinical trials 2016;47: 356-365.