The Livermeeting ® 2012, 9.-13. November 2012 in Boston Therapie ohne Interferon kommt

Auch auf der 63. Jahrestagung der American Association of the Study of the Liver (AASLD)stand wieder die Hepatitis-C-Therapie im Mittelpunkt. Ein Schwerpunkt war die Therapie von schwer zu behandelnden Patienten mit Zirrhose und Transplantationspatienten mit den verfügbaren Tripletherapien. Hauptgesprächsthema waren die Interferon-freien, oralen Therapieregime, die eine sehr gute Wirksamkeit zeigten. Bei weniger potenten Substanzen ist Ribavirin ohne Interferon aber weiterhin nötig.
Auch dieses Mal war es wieder schwierig, bei der großen Menge an neuen Studien, Updates und neuen Substanzen, die zu Hepatitis C präsentiert wurden, den Überblick zu behalten. Hilfreich war das „Hepatitis Debrief“ – Raymond Chung, Direktor der Hepatologie am Massachusetts General Hospital, Boston, präsentierte am letzten Tag im Schnelldurchgang 30 Minuten lang die wichtigsten Daten. Im großen Auditorium war kaum ein Stuhl leer.
Ohne Interferon
Laut Chung ist die Aussicht auf gut verträgliche und hochpotente komplett orale Therapieregime sehr gut, deshalb wird auch die Schwelle, mit der aktuell verfügbaren Standardtherapie abzuwarten, steigen. Er schätzt, dass in weniger als zwei Jahren ein einfaches, gut verträgliches Interferon-freies Therapieregime verfügbar sein wird. Eine Interferon-freie Therapie setzt sich entweder aus zwei Substanzen mit einer hohen genetischen Barriere zusammen oder besteht aus mehreren schwächeren direkt antiviral wirkenden Medikamenten (DAA), die an verschiedenen Vermehrungsschritten des Virus ansetzen (Tab. 1). Mit den Interferon-freien Therapien sind auch bei Nullrespondern und Patienten mit Zirrhose gute Heilungschancen zu erwarten. Chung hob hervor, dass der IL28B-Status und HCV-Subtyp eine wichtige Rolle bei einigen DAAs spielen, d.h. HCV-Genotyp 1a kombiniert mit IL28B non-CC ist schwieriger zu behandeln als HCV-Genotyp 1a kombiniert mit IL28B CC und als der Subtyp 1b. Therapieregime aus vier Substanzen (Quad- Regime) und Therapien, die ein auf Wirtsstrukturen zielendes antivirales Medikament (host targetd antiviral, HTA) enthalten, sieht Chung als Salvagetherapie bei Nullrespondern und Nonrespondern unter DAAs. Chung warf mehrere Fragen auf: Wird eine verkürzte Therapie, die Interferon enthält, akzeptiert werden? Welche Rolle werden die Kosten bei der Therapieentscheidung spielen? Wird die HCV-Therapie eine „one size fits all“ oder eine individualisierte Therapie? Und welchen Stellenwert werden IL28B und HCV-Subtyp weiterhin haben?
 Tab. 1 Übersicht experiemtelle Therapieregime, nach Chung R. Hepatitis Debrief, AASLD 2012
Tab. 1 Übersicht experiemtelle Therapieregime, nach Chung R. Hepatitis Debrief, AASLD 2012
Boceprevir und Telaprevir
Zahlreiche Studien beschäftigten sich mit den aktuell verfügbaren HCV-Proteasehemmern Boceprevir und Telaprevir. Wie kann die Therapie verbessert und an bestimmte Patientengruppen angepasst werden? Zwei retrospektive Untersuchungen an erfahrenen Zentren zeigten, dass man in der klinischen Praxis noch zurückhaltend ist und das Management der Nebenwirkungen schwierig ist. Die Abbruchraten waren höher als in den klinischen Studien. Eine Tripletherapie wurde im ersten Jahr der Zulassung in Miami und Dallas nur bei 19% von 454 HCV-Patienten GT1 begonnen (37% Fibrose Grad 3, 41% kompensierte Zirrhose, 7% therapienaiv, 27% Nonresponder, 44% Relapser) (Chen E et al. #133). 21% der Patienten beendeten die Tripletherapie vor Woche 12. Die Gründe waren zu frühes Krankheitsstadium (19%), Komorbidität (18%) und fortgeschrittene Erkrankung (21%). Im Mount Sinai Medical Center und im Montefiore Hospital wurde bei 32% von 157 Patienten mit und ohne fortgeschrittene Fibrose die Telaprevir-haltige Tripletherapie vorzeitig beendet, davon bei 21% wegen der Nebenwirkungen (Bichoupan K et al. #1755).
Die relativ häufige therapieinduzierte Anämie lasst sich gut mit einer Ribavirin-Dosisreduktion als Mittel der ersten Wahl bei therapienaiven Patienten managen. Eine weitere Analyse zum Vorgehen bei therapieinduzierter Anämie ergab, dass sowohl der Zeitpunkt als auch das Ausmaß der niedrigeren Ribavirindosis sich nicht auf die SVR-Rate unter einer Boceprevir-haltigen Tripletherapie auswirkten (Poordard F et al. #154). Eine SVR erreichten bei nicht nachweisbarer HCV-RNA zum Zeitpunkt der Ribavirin-Dosisreduktion 86% der Patienten und bei nachweisbarer Virämie 56% der Patienten. Eine Subanalyse dieser Anämiemanagement-Studie bestätigte, dass die Anämie auch bei HCV-Patienten mit Zirrhose ohne Wirkverlust mit weniger Ribavirin gemanagt werden kann (Lawitz E et al. #50).
Bei RVR keine Tripletherapie?
Bei HCV-Patienten Genotyp 1 mit niedrig replikativer Infektion (LVL, <600.000 IU/ml) scheint es möglich zu sein, auf den Proteasehemmer zu verzichten, wenn sie nach 4 Wochen dualer Therapie virologisch ansprechen (RVR, rapid virological response) (Pearlman B et al. #151) Von 179 Patienten mit LVL erreichten 88% eine RVR. Sie erhielten randomisiert die duale Therapie für 20 weitere Wochen oder die Tripletherapie mit Boceprevir für weitere 24 Wochen. Eine SVR12 erzielten 90% der Patienten unter der dualen Therapie und 89% unter der Tripletherapie, unabhängig vom IL28B-Status, HCV-Subtyp und von der Ethnizität.
Telaprevir BID
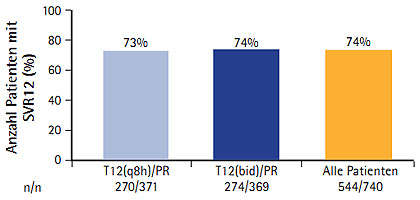 Abb. 1 OPTIMIZE-Studie: Kein Wirkverlust mit Telaprevir zweimal statt dreimal täglich (Buit M et al. #LB-8)
Abb. 1 OPTIMIZE-Studie: Kein Wirkverlust mit Telaprevir zweimal statt dreimal täglich (Buit M et al. #LB-8)
Die Tagesdosis von Telaprevir konnte ohne Wirkverlust auf zwei Dosierungen verringert werden, wie erste Ergebnisse der Studie OPTIMZE zeigten (Buit M et al. #LB-8). Eine SVR12 erzielten 74% der therapienaiven Patienten mit 2x täglich drei Tabletten à 375 mg alle 12 Stunden und 73% der Patienten mit 3x täglich zwei Tabletten à 375 mg alle 8 Stunden (Abb. 1). Das Erreichen einer SVR12 war mit beiden Therapieschemata unabhängig vom Leberfibrosestadium und IL28B-Genotyp vergleichbar. In beiden Gruppen konnte bei jeweils zwei Drittel der Patienten aufgrund des raschen virologischen Ansprechens die Therapie nach 24 Wochen beendet werden. Die Einreichung der Zulassungsunterlagen ist geplant.
Zirrhose-Patienten
Mit Spannung wurde das Update der CUPIC-Studie erwartet, in der die Daten des französischen Expanded Access Programms zu Boceprevir und Telaprevir gemeinsam ausgewertet werden. Präsentiert wurden wie auf dem diesjährigen europäischen Leberkongress EASL aber nur die 16-Wochen-Daten, allerdings mit mehr Boceprevir-Patienten (Hézode C et al. #51). Die aktuelle vorläufige Auswertung basiert auf den 16-Wochen-Daten von 497 Non-Respondern mit Zirrhose (BOC n=205 und TLV n=292). Viel hat sich im Vergleich zur ersten Auswertung nicht geändert: Eine nicht nachweisbare Viruslast zu Woche 16 hatten 58% (BOC) bzw. 76% (TLV) der Patienten und schwere Nebenwirkungen traten bei 33% bzw. 45% der Patienten auf. Da die Boceprevir-Patienten die Tripletherapie noch weitere 36 Wochen einnehmen und die Telaprevir-Patienten nach Woche 12 nur noch die duale Therapie erhalten, darf man gespannt sein, wie sich die vorläufigen Daten zur Wirksamkeit und Verträglichkeit ändern werden.
Transplantations-Patienten
Insgesamt 8 Kohortenstudien wurden zum Thema Tripletherapie und Lebertransplantation bei HCV-Patienten Genotyp 1 vorgestellt. Darunter eine französische Kohorte mit 37 und die US-amerikanische CHRUSH-C-Kohorte mit 61 Post-Transplantationspatienten (Coilly A et al. #9; Burton J et al. #211). Jacqueline O’Leary fasste in einem Übersichtsvortrag die Daten der 8 Kohorten und einer Veröffentlichung (Werner C et al. Livertransplant 2012) zusammen. Die gepoolte Analyse basiert auf den Daten von 204 Patienten, die im Kontext der Lebertransplantation eine Tripletherapie mit Boceprevir (n=19%) und Telaprevir (n=81%) erhielten. Bei zwei Drittel der Patienten wurde Cyclosporin und bei einem Drittel Tacrolimus eingesetzt. 70% der Lebertransplantierten hatten nach 12 Wochen Tripletherapie eine nicht nachweisbare Viruslast. Insgesamt wurde die Therapie bei 30% vorzeitig beendet, davon bei einem Drittel wegen Nebenwirkungen und bei zwei Drittel wegen Nonresponse. Aufgrund der in Studien gezeigten Vorhersagbarkeit einer SVR24 auf Basis einer nicht nachweisbaren Virämie nach 12 Wochen Therapie, könnten 56% der Transplantationspatienten eine SVR24 erreichen. Eine Anämie und eingeschränkte Nierenfunktion sind kritisch, dabei könnte eine Lead-in-Phase mit einschleichender pegIFN/RBV-Dosis (low accelerating dose regimen, LADR) hilfreich sein. Die HCV-Proteasehemmer gehen mit den Immunsuppressiva Interaktionen ein. In diesem Fall ist Cyclosporin einfacher zu steuern. Patienten, die mit Tacrolimus behandelt werden müssen, sollten engmaschiger monitoriert werden.
Triple- und Quadtherapie mit neuen DAAs
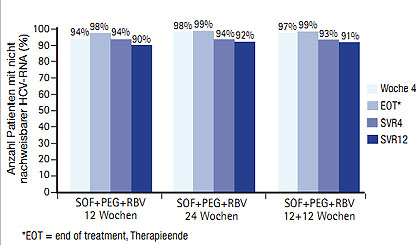 Abb. 2 ATOMIC-Studie: rasches Ansprechen und mehr als 90% SVR12 mit Sofosbuvir-¬basierter Tripletherapie (Hassanein T et al. #230)
Abb. 2 ATOMIC-Studie: rasches Ansprechen und mehr als 90% SVR12 mit Sofosbuvir-¬basierter Tripletherapie (Hassanein T et al. #230)
Abb. 3 MATTERHORN-Studie: SVR-12-Raten der Quad-Therapie Danoprevir, Mericitabin und pegIFN/RBV nach Genotyp 1 a und 1b (Feld J et al. #81)
Neue DAAs werden nach wie vor auch als Tripletherapie mit pegIFN/RBV kombiniert und ergeben damit sehr gute Ansprechraten. In der Studie ATOMIC erzielten mehr als 90% der therapienaiven Patienten Genotyp 1 eine SVR12, die 12 oder 24 Wochen lang mit dem Nukleotidanalogon Sofosbuvir (ehemals GS-7977) 1x täglich 400 mg und pegIFN/RBV behandelt wurden (Hassanein T et al. #230) (Abb. 2). Nach 24 Wochen Tripletherapie erzielten auch 100% der Patienten mit dem Genotyp 6 und 82% der Patienten mit dem Genotyp 4 eine SVR12. Ein Relapse war selten und eine primäre Resistenz konnte bisher nicht nachgewiesen werden. Ein schwerwiegendes Ereignis trat unter Sofosbuvir nicht auf.
Der NS4A-Inhibitor Daclatasvir (ehemals BMS -790052) war in Kombination mit pegIFN/RBV nicht ganz so wirksam wie Sofosbuvir. In der Studie COMMAND erreichten eine SVR12 mit der 60 mg-Dosierung 64% der Genotyp-1-Patienten (58% GT1a und 87% GT1b) und 100% der Genotyp-4-Patienten (Hézode C et al. #762; Dore Ge t al. #762). Mit einer Quad-Therapie über 24 Wochen konnte mit Daclatasvir, dem HCV-PI Asunaprevir (ehemals BMS-650032) und pegIFN/RBV bei 95% der schwer zu behandelnden Nullrespondern Genotyp 1a eine SVR24 erreicht werden (Lok A et al. #79). Eine weitere experimentelle Quad-Kombination mit dem geboosterten HCV-PI Danoprevir/r (ehemals RG7227), dem nukleosidalen Polymerasehemmer (NI) Mericitabin (ehemals RG7128) plus pegIFN/RBV konnte bei 100% der Nullresponder Genotyp 1b und bei 73% Genotyp 1a eine SVR12 induzieren (MATTERHORN-Studie; Feld J et al. #81) (Abb. 3).
Ob sich eine Quadruple-Therapie bei Patienten mit Genotyp 1 und dem günstigen IL28B-CC auf insgesamt sechs Wochen verkürzen lässt, wurde in an 235 therapienaiven Patienten ohne Zirrhose untersucht (Thompson A et al. #759). Sie erhielten randomisiert den NS5A-Inhibitor GS-5885 und den PI GS-9441 plus pegIFN/RBV für 6 oder 12 Wochen. In der Interimanalyse hatten eine SVR4 jeweils 100% (14/14 bzw. 10/10) der Patienten mit der 6-wöchigen bzw. 12-wöchigen Therapie.
Interferon Lambda
Auch mit dem pegyliertem Interferon Lambda sprechen therapienaive HCV-Patienten Genotyp 1 in Kombination mit Daclatasvir (n=41) und Asunaprevir (n=38) (jeweils plus RBV) gut an (D-LITE-Studie; Vierling J et al. #LB-9). 90% der Patienten unter Daclatasvir und 84% unter Asunaprevir erreichten ein Protokoll-definiertes Ansprechen (HCV-RNA <25 IU/ml Woche 4 und 12) und konnten nach 12 Wochen die Therapie beenden. Die SVR12-Raten betrugen 76% bzw. 75%. Patienten mit dem Genotyp 1b sprachen besser an.
Als Dosierung für das Interferon Lambda wurde 180 μg gewählt. Mit dieser Dosierung sprachen Patienten mit Genotyp 1 und 4 unter Lambda/RBV schneller an als unter dem pegyliertem Interferon alfa, die SVR-Raten waren aber vergleichbar (37,3% vs 36,9%) (EMERGE-Studie; Muir A et al. #214). Mit Interferon Lambda traten in der Studie weniger neuropsychiatrische Nebenwirkungen und Störungen der Schilddrüsenfunktion auf (Fredlund P et al. #781).
Interferon-freie Therapien
Die Interferon- und Ribavirin-freie duale Therapie mit Daclatasvir (60 mg QD) und Asunaprevir (200 mg BID) für 24 Wochen ergab bei Nullrespondern mit Genotyp 1b eine SVR12-Rate von 78%, mit der Asunaprevir BID-Dosierung betrug die SVR12-Rate 65% SVR12 (Lok A et al. #79).
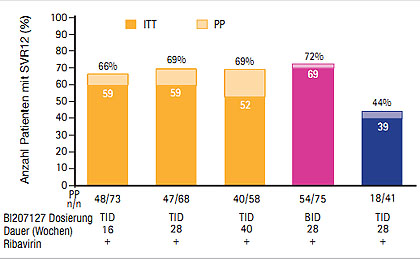 Abb. 4 SOUND-¬C-¬Studie: SVR12 unter Faldaprevir und BI20727 mit und ohne Ribavirin (Zeuzem S et al. #232)
Abb. 4 SOUND-¬C-¬Studie: SVR12 unter Faldaprevir und BI20727 mit und ohne Ribavirin (Zeuzem S et al. #232)
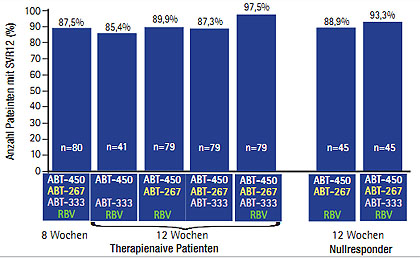 Abb. 5 AVIATOR-Studie: SVR12 nach 8- und 12-wöchiger Interferon-freier Therapie (Kowdley C et al. #LB-1)
Abb. 5 AVIATOR-Studie: SVR12 nach 8- und 12-wöchiger Interferon-freier Therapie (Kowdley C et al. #LB-1)
Vielversprechend sind auch die Daten der SOUND-C2-Studie mit dem Interferon-freien Therapieregime aus dem PI Faldaprevir (ehemals BI201335), dem nicht-nukleosidalen Polymerasehemmer (NNI) BI207127 mit und ohne Ribavirin (Zeuzem S et al. #232). In SOUND-C2 wurden 362 therapienaive Patienten Genotyp 1 in fünf verschiedenen Arme randomisiert. Am besten schnitt die Kombination aus 120 mg QD Faldaprevir plus 600 mg BID BI201127 plus Ribavirin ab: 69% der Patienten erreichten damit eine SVR12 (Abb. 4). Allerdings war der Therapieerfolg mit diesem Regime auch beim Genotyp 1a schlechter als beim Genotyp 1b (43% vs 85%) und die Relapse-Rate betrug 47% vs 8%. In dieser Studie bestätigte sich, dass eine SVR12 ein guter Prädiktor für eine SVR24 mit Interferon-freier Therapie ist – die Konkordanz zwischen SVR12 und SVR24 lag bei 100%. Das BID-Regime wurde gut vertragen (36% mittelschwere und 12% schwerwiegende unerwünschte Ereignisse), eine Bilirubinerhöhung Grad 3 entwickelten 26% und Grad 4 13% der Patienten. In SOUND-C2 hatten 33 (9%) Patienten eine Leberzirrhose und 6/9 (67%) Patienten erreichten eine SVR12, mit Genotyp 1b waren es 80% (4/5) (Soriano V et al. # 84).
Eine SVR4-Rate von 94% erzielte die Triple-DAA-Therapie Daclatasvir, Asunaprevir und dem NNI BMS-791325 bei therapienaiven Patienten Genotyp 1 sowohl nach 12 Wochen als auch nach 24 Wochen Therapiedauer (Everson G et al. #LB-3). Bislang beendete kein Patient vorzeitig die Therapie wegen Nebenwirkungen. Mehr als 10% der Patienten berichteten über Diarrhö.
Auch mit der Triple-DAA-Therapie aus dem geboosterten PI ABT-450/r, dem NS5A-Inhibitor ABT-267 und dem NNI ABT-333 ist Ribavirin nicht nötig (AVIATOR-Studie; Kowdley C et al. #LB-1). Therapienaive Patienten (n=438) und Nullresponder (n=133) erhielten ABT-450/r mit ABT-267 und ABT-333 oder einem dieser beiden DAAs mit und ohne Ribavirin für 8, 12 und 24 Wochen. Mit 12 Wochen Triple-DAA und Ribavirin ergab die Interimsanalyse für naive Patienten 97% SVR12 (ohne Ribavirin 87%) und für Nullresponder 93% SVR12 (Abb. 5). Die SVR-Raten der anderen Studienarme lagen zwischen 89 und 92%. Die Therapien wurden gut vertragen, ein SAE wurde bisher nicht berichtet.
Daclatasvir plus Sofosbuvir
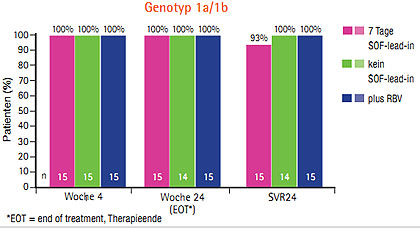
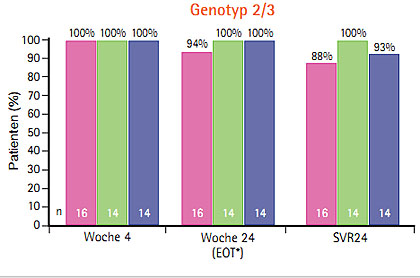 Abb. 6 Duale Therapie mit Daclatasvir und Sofosbusvir bei Genotyp 1a, 1b, 2 und 3 100% SVR24 (Sulkowski M et al. #LB-2)
Abb. 6 Duale Therapie mit Daclatasvir und Sofosbusvir bei Genotyp 1a, 1b, 2 und 3 100% SVR24 (Sulkowski M et al. #LB-2)
Die bisher besten Resultate ergab die duale Therapie Daclatasvir und Sofosbuvir – jeweils 100% der therapienaiven Patienten mit Genotyp 1a, 1b, 2 und 3 erreichten eine SVR24 (Sulkowski M et al. #LB-2) (Abb. 6, Seite 12). Das Nebenwirkungsprofil dieser dualen Therapie war günstig, die Patienten berichteten über Müdigkeit, Kopfschmerzen und Übelkeit, eine Anämie trat nur im Arm mit Ribavirin auf. Diese Kombination wird jedoch nicht weiterentwickelt, da Gilead mit GS5885 einen eigenen NS5A-Inhibitor hat, mit dem in Studien bereits mehr als 1.000 Patienten behandelt wurden und werden und eine fixe Kombination in einer Tablette geplant ist (Everson G et al. #783).
Hepatitis B
Aktuelle Updates der Langzeitstudien für Entecavir und Tenofovir belegten, dass die beiden Monotherapien langfristig wirksam sind. Für Tenofovir wurden die 6-Jahresdaten der beiden Extensions-Studien der Zulassungsstudien 102 und 103 vorgestellt (Marcellin P et al. #374). Demnach sind noch 78% bzw. 65% der Patienten in den Studien, 81% bzw. 62% (ITT) sprachen nach wie vor virologisch an, die HBeAg-Serokonversionsrate betrug 37% und bei 24 Patienten trat ein HBsAg-Verlust auf. Für Entecavir liegen jetzt 5-Jahresdaten aus der italienischen Entecavir-Kohorte vor (Lampertico P et al. #366). In dieser Kohorte ist der Anteil an Patienten mit Zirrhose (49%) und Komorbidität (56%) relativ hoch. Bei allen 97 Patienten, die bereits das 5-Jahres-Follow-up erreichten, ist die HBV-DNA nicht nachweisbar. Eine HBeAg-Serokonversion trat bei 28 (52%) Patienten und eine HBsAg-Verlust bei 13 33%) Patienten auf.
Leberkrebs verhindern
Telaprevir bei HIV/HCV-Koinfektion
Die endgültige Auswertung der Telaprevir-Studie bei HIV/HCV-koinfizierten Patienten liegt vor: Bei 74% der Patienten konnte mit der Tripletherapie eine SVR24, d.h. eine Heilung der HCV erreicht werden, mit der dualen Therapie war das nur bei 45% der Fall (Sulkowski M et al. #54). Die HIV-Therapie bestand entweder aus Efavirenz (höhere Telaprevir-Dosis notwendig) oder Atazanavir/r jeweils in Kombination mit Tenofovir und Emtricitabin oder 3TC. Das Nebenwirkungsprofil entsprach nach wie vor dem bei HCV-monoinfizierten Patienten.
Akute HCV bei HIV
Die Behandlung einer akuten HCV-Infektion bei HIV-Patienten mit pegyliertem Interferon plus Ribavirin (pegIFN/RBV) erhöht bei den HCV-Genotypen 2 und 3 die Heilungsraten um 30% im Vergleich zu einer pegIFN-Monotherapie (94% versus 60%, p=0,016) (Boesecke C et al. #49). Bei den Genotypen 1 und 4 waren die Heilungsraten dagegen vergleichbar (66% versus 70%). Behandelt wurden 303 HIV-Patienten aus UK, Frankreich, Deutschland und Österreich, davon 273 mit pegIFN und 30 mit pegIFN alleine. In 88% der Fälle wurde Ribavirin gewichtsadaptiert eingesetzt (≤75 kg 1.000 mg und >75 kg 1.200 mg).
Hepatitis D und HCC
Eine chronische Infektion
mit dem Hepatitis-D-Virus (CHD) geht nicht mit einem höheren HCC-Risiko einher.
In der Medizinischen Hochschule Hannover wurden 75 Patienten mit einer
HDV/HBV-Koinfektion mit 101 HBV-Patienten gematcht und rund 5 Jahre
nachbeobachtet (Calle Serrano B et al. #355). Eine Zirrhose entwickelte sich
bei HDV/HBV-Patienten früher (2,7 versus 3,6 Jahre) und häufiger (50 versus
13%), die Entwicklung zu einem HCC unterschied sich dagegen nicht (Inzidenz 1,2
bzw. 1,1). Patienten ohne Zirrhose entwickelten kein HCC.
Die höhere HCC-Prävalenz in früheren Studien und Kohorten scheint eher auf die
schnellere Progression als auf einen HDV-spezifischen onkogenen Faktor
zurückzuführen zu sein.
Zwei japanische Studien konnten zeigen, dass Entecavir die Inzidenz von hepatozellulären Karzinomen (HCC) verringert. In einer prospektiven Studie mit 472 konsekutiven NA-naiven Patienten entwickelten im Verlauf von fünf Jahren (medianes Follow-up 3,2 Jahre) 3,7% der Patienten unter Entecavir ein HCC im Vergleich zu 13,7% der Patienten aus einer historischen Kontrollgruppe (Hosaka T et al. #357). Prädiktive Faktoren für ein HCC waren Alter, Alkoholkonsum, Zirrhose, HBeAg-Positivität und niedriger Thrombozytenwert, ein positiver Prädiktor war die Entecavir-Behandlung. In der zweiten Studie (ohne Kontrollgruppe) entwickelten 9% von 555 NA-naiven Patienten innerhalb von 8 Jahren ein HCC (Yamada R et al. #416). Die HCC-Inzidenz war bei den Patienten ohne Zirrhose niedriger, wenn die Virusreplikation unter der Therapie langfristig supprimiert war.
Wann Therapie absetzen?
Bei einem HBsAg-Verlust kann eine antivirale Therapie abgesetzt werden wenn eine HBsAg-Serokonversion auftritt oder nach einer mindestens 12-monatigen Konsolidierungsphase nach dem HBsAg-Verlust (Invernizzi F et al. #362). In einer Studie mit 520 Patienten, die zwischen 1997 und 2008 mit Nukleos(t)idanaloga behandelt wurden, verloren 29 (6%) das HBsAg und wurden danach durchschnittlich 42 (1-117) Monate nachbeobachtet. 21 Patienten mit einem anti-HBs-Titer von >10 IU/ml beendeten die Therapie 12 (1-16) Monate nach HBsAg-Verlust und 8 Patienten ohne einen signifikanten anti-HBs-Titer beendeten die Therapie während der 27 Monate dauernden Konsolidierungsphase, davon trat bei 6 Patienten eine HBsAg-Serokonversion auf.
Interferon: add-on und Switch
Eine Möglichkeit, die antivirale HBV- Therapie endlich zu machen, könnte die zusätzliche Gabe von Interferon sein. Diese Therapiestrategie wurde in der Studie ARES an 160 NA-naiven HBeAg-positiven Patienten untersucht (Sonneveld M et al. #19). Die Patienten erhielten entweder 0,5 mg Entecavir für 24 Wochen und für weitere 24 Wochen zusätzlich Peg-interferon alfa 2a 180 μg/Woche (n=77) oder 48 Wochen lang eine Entecavir-Monotherapie (n=83). Ein HBeAg-Verlust und der kombinierte Endpunkt (HBeAg- Verlust plus HBV-DNA<200 IU/ml) waren tendenziell häufiger in der Add-on-Gruppe (jeweils 18% vs 8%; p=0,068). Die Patienten werden weiter mit Entecavir behandelt und nachbeobachtet.
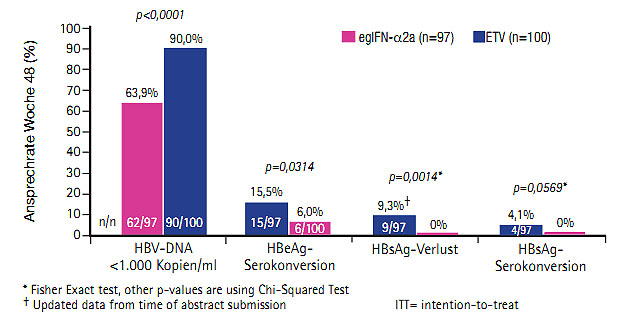 Abb. 7 Switch von Entecavir auf Interferon erhöht die Chance auf Serokonversion (Ning Q et al. #216)
Abb. 7 Switch von Entecavir auf Interferon erhöht die Chance auf Serokonversion (Ning Q et al. #216)
Der Switch von einer Entecavir-haltigen Therapie auf Interferon ging mit einer signifikant höheren Rate von HBeAg-Serokonversion (15,5% vs 6,0%) und HBsAg-Verlust (9,3% vs 0%) einher als die Weiterführung mit der Entecavir-Monotherapie (Ning Q et al. #216) (Abb. 7). War der HBsAg-Titer zu Baseline niedrig (<1.500 IU/ml), erhöhte sich die Rate der HBeAg-Serokonversion auf 37,5% und des HBsAg-Verlustes auf 25%. Die Patienten (n=200) hatten vor der Studie für 9-36 Monate eine stabile Entecavir-Therapie erhalten und wurden randomisiert entweder für 48 Wochen auf pegyliertes Interferon alfa-2a umgestellt (die ersten 8 Wochen zusätzlich Entecavir) oder 48 Wochen lang mit Entecavir weiterbehandelt.





