Dietmar Klass, Ulm
Mit oder ohne Lead-in?
Unter dem Begriff „Lead-in” versteht man eine vierwöchige Standardtherapie mit pegyliertem Interferon (PegIFN) und Ribavirin (RBV) vor Beginn einer Tripletherapie mit einem Proteaseinhibitor (PI), insbesondere mit dem PI Boceprevir (BOC). Hinter dem Konzept steht die Idee, dass PegIFN und RBV zunächst eine konstante Konzentration erreichen sollten, um der Entstehung von Resis-tenzmutationen nach Hinzunahme des PI entgegenzuwirken.
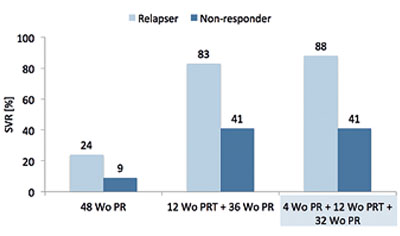
Abbildung 2: SVR Ergebnisse der TVR Phase III Studie (REALIZE)
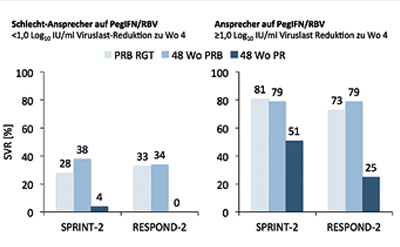
Abbildung 3: SVR-Raten nach Ansprechen zu 4 Wochen Lead-in

Abbildung 3: SVR-Raten nach Ansprechen zu 4 Wochen Lead-in
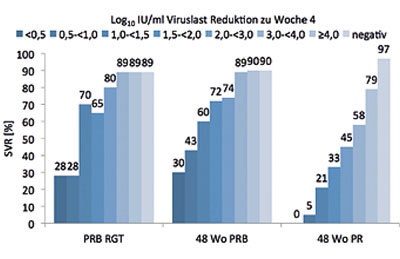
Abbildung 4: SVR-Raten nach Ansprechen zu 4 Wochen Lead-in (SPRINT-2)
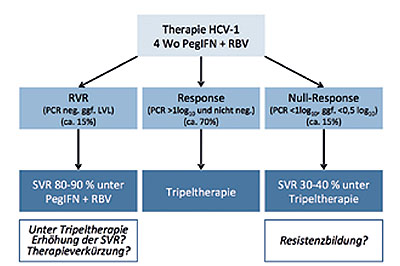
Abbildung 5: Überlegungen zum Therapiealgorithmus mit Lead-in
Das Konzept wurde erstmals in einer größeren Phase-II-Studie mit dem PI Boceprevir (SPRINT-1) getestet. Hierbei zeigte sich ein geringer Vorteil für die beiden Arme mit Lead-in (Abb. 1). Im weiteren Verlauf der Boceprevir-Entwicklung wurde daher nur noch Studien mit Lead-in durchgeführt. In den Zulassungsstudien von Telaprevir wurde nur im Rahmen der REALIZE-Studie (vorbehandelte Patienten) das Lead-in Konzept einer vierwöchigen Phase mit PegIFN/RBV getestet. Dabei konnte kein Vor- oder Nachteil gegenüber dem Arm mit sofortigem Start der antiviralen Tripeltherapie festgestellt werden (Abb. 2).
Marker für Ansprechen
„Lead-in“ bedeutet im Englischen aber nicht nur anführen, heranführen, einleiten, sondern auch ausloten. Das Konzept der Lead-in Phase lässt sich dahingehend ausweiten, die gewonnenen Informationen nach vier Wochen Standardtherapie auszuwerten. Subanalysen der Daten aus den Zulassungsstudien SPRINT-2 und RESPOND-2 zeigen, dass Patienten, deren HCV-Viruslast nach dem vierwöchigen Lead-in um weniger als 1 log 10 abgefallen war, deutlich schlechtere „sustained viral response“ (SVR)-Raten hatten, trotz der Addition von Boceprevir (Abb. 3). Diese Informationen lassen sich nicht nur im Sinne einer negativen Prädiktion verwerten. Patienten, die nach dem Lead-in ein „rapid viral response“ (RVR) zeigen, haben bereits unter einer Standardtherapie eine Chance von ca. 90 %, eine SVR zu erreichen, und dies ließ sich auch durch Zugabe von Boceprevir nicht weiter signifikant steigern (Abb. 4).
Klinisch relevant können auch die Informationen zur Verträglichkeit der Standardtherapie sein. So lässt sich der Abfall des Hämoglobins durch Ribavirin abschätzen und die Ribavirin-Dosis kann gegebenenfalls bereits reduziert werden. Auch bei weiteren häufigen Nebenwirkungen der Behandlung, z.B. Kopfschmerzen, gastrointestinalen Beschwerden usw. können die Effekte von Standardtherapie und Proteasehemmern möglicherweise besser unterschieden werden.
Zulassungssituation
Derzeit ist die Durchführung einer Lead-in-Phase bei einer Tripeltherapie mit Boceprevir zugelassen. In der Fachinformation von Telaprevir wird eine Lead-in- Phase mit Bezug auf die REALIZE-Studie erwähnt und nicht explizit ausgeschlossen. Das bedeutet, dass die Durchführung einer Lead-in-Phase bei einer Therapie mit Boceprevir vorgesehen ist und bei einer Therapie mit Telaprevir zumindest als Möglichkeit genannt wird.
In Anbetracht der nicht unerheblichen zusätzlichen Nebenwirkung und der Kosten für eine PI-Therapie erscheint es daher sinnvoll, bei den Patienten ein Lead-in mit nachfolgender HCV-RNA Bestimmung durchzuführen, bei denen der Verzicht auf eine Tripeltherapie eine Option ist. Damit sind im Besonderen Patienten mit positiven Prädiktoren für eine SVR gemeint, wie z.B. Fibrose ≤1, IL28b CC-Genotyp, usw.
Potentielle Probleme
Ein Lead-in erscheint auf den ersten Blick nicht als Nachteil. Beim Einsatz dieser Vorphase sind jedoch auch potentielle Probleme zu beachten. Erstens profitieren vermutlich nur ca. 15% der Patienten von einem Lead-in, nämlich diejenigen, die aufgrund einer RVR auf den Einsatz eines PI verzichten können. Dem gegenüber steht ein Mehraufwand an logistischer Arbeit (PCR-Ergebnisse zu Woche 4), eine vermehrte Komplexität der Therapie für den Patienten und den Therapeuten, sowie auch das Risiko, die Therapieadhärenz zu reduzieren, wenn das Ansprechen schlecht und bereits die Standardtherapie sehr nebenwirkungsreich ist. Daher scheint es sinnvoll, bei Patienten, bei denen man in jedem Fall einen Proteaseinhibitor einsetzen will, auf das Lead-in zu verzichten.
Fazit
Eine Lead-in Phase als zusätzlicher Marker für ein dauerhaftes virologisches Ansprechen erscheint grundsätzlich von Vorteil. Insbesondere ist ein Lead-in für die Patienten von Relevanz, die bereits nach vier Wochen Standardtherapie HCV-RNA negativ sind, da sie nicht von der zusätzlichen Gabe eines Proteaseinhibitors profitieren (Abb. 5). Ob diese Gruppe der Patienten jedoch noch einer weiteren Therapieverkürzung mit einem PI zugeführt werden können, müssen weitere Studien zeigen. Beim Einsatz von Telaprevir in einer Tripeltherapie ist durch ein Lead-in keine besseren Ansprechrate zu erwarten.
Literatur
Kwo PY, Lawitz EJ, McCone J, Schiff ER, Vierling JM et al. Efficacy of boceprevir, an NS3 protease inhibitor, in
combination with peginterferon alfa-2b and ribavirin in treatment-naive patients with genotype 1 hepatitis C infection
(SPRINT-1):
an open-label, randomised, multicentre phase 2 trial. Lancet 2010; 376(9742): 705-16.
Poordad F, McCone J, Bacon BR, Bruno S et al. Boceprevir for untreated chronic HCV genotype 1 infection. N Engl J Med 2011; 364: 1195-206.
Bacon BR, Gordon SC, Lawitz E, Marcellin P et al. Boceprevir for previously
treated chronic HCV genotype 1
infection. N Engl J Med 2011; 364: 1207-17.
Zeuzem S, Andreone P, Pol S, Lawitz E et al. Telaprevir for retreatment of HCV infection. N Engl J Med 2011; 364: 2417-28.
Vierling JM, E.J. Lawitz EJ, Poordad F, Sulkowski MS et al. Four-week therapy with Peginterferon
alfa-2b/Ribavirin effectively predicts sustained virologic response in treatment-naïve and previous-treatment failure
patients with HCV-1 treated with Boceprevir plus Peginterferon alfa-2b/Ribavirin. EASL 2011,
Abstract 481.





