Philippe L. Pereira, Heilbronn
Interventionelle Radiologie bei HCC
Mehr als 90% der Patienten mit einem HCC haben eine chronische Lebererkrankung. Trotz der allgemein schlechten Prognose stehen folgende Therapiemöglichkeiten zur Verfügung:
- Kurative Therapien: die Lebertransplantation, die chirurgische Resektion und die thermoablativen Verfahren
- Neoadjuvante Therapien, deren Effektivität noch nicht demonstriert ist
- Palliative Therapien mit dem Ziel, das Überleben bzw. die Lebensqualität dieser Patienten zu verbessern.
Die chirurgische Resektion wird bei Patienten mit oberflächlichem solitärem HCC, guter Leberfunktion ohne portale Hypertension durchgeführt. Die Lebertransplantation ist insbesondere bei Patienten mit dekompensierter Leberzirrhose und HCC nach den Milanokriterien indiziert. Die Thermoablation ist die beste therapeutische Option für die nichtchirurgische Behandlung von Patienten im Frühstadium der Erkrankung.
Transarterielle Chemoembolisation und Embolisation
Patienten, die für eine chirurgische oder thermoablative Therapie nicht in Frage kommen, meist aufgrund des fortgeschrittenen Tumorstadiums oder Begleiterkrankungen, können von einer transarteriellen Chemoembolisation (TACE) profitieren. Zwei randomisierte Studien zeigen einen signifikanten Überlebensvorteil der TACE im Vergleich zur supportiven Therapie.1, 2
Das Prinzip der TACE basiert auf der selektiv regionalen Injektion
eines Zytostatikums mit anschließender Okklusion der tumorversorgenden
Arterien. Die entscheidenden Parameter für das Ausmaß der Tumorzerstörung und
damit der
Prognose sind die hohen
Zytostatikakonzentrationen innerhalb des HCC sowie die Devaskularisation des
Tumors.
Bei der Standard-TACE wird eine Kombination verschiedener Zytostatika, die mit Lipiodol zu einer Emulsion gemischt werden, eingesetzt. Durch das Fehlen des Reticulo-Endothelialen-Systems (RES) im Tumorgewebe kommt es zu einer verzögerten Auswaschung des Zytostatikums und einer längeren Tumorexposition in konstanten hohen Dosen.3 Die zusätzliche Embolisation z.B. mit Polyvinyl-Alkohol (PVA)-Partikeln wird noch kontrovers diskutiert.
Im Vergleich zur Standard-TACE stehen jetzt Mikrosphären (kleine Molekülaggregate), die retardiert Zytostatika abgeben, zur Verfügung: das Embolisat DC-Beads (Biocompatibles, UK) ein Mikrosphärenprodukt mit PVA-Partikeln, die mit Anthrazyklinen kombiniert sind, und das Embolisat Embocept (Pharmacept, Germany), ein hydrolisiertes Produkt mit Epichlorohydin. Verglichen mit der Standardmethode wird hier eine kontinuierliche hohe Konzentration des Zytostatikums von bis zu 3 Monaten erreicht.3
Als häufige Nebenwirkung der TACE tritt das Postembolisationssyndrom (PES) mit Bauchschmerzen, Übelkeit und Fieber in 10-90% der Fälle auf.4 Die Raten der Major-Komplikationen nach TACE liegen in der Literatur bei 2%-7% je nach Technik und Erfahrung des interventionellen Onkologen.4
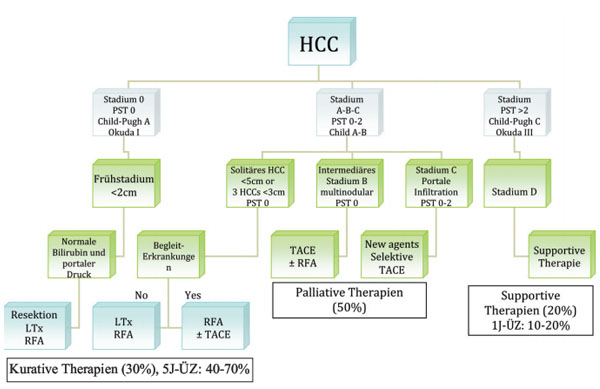
Tab. 1: Strategie der verschiedenen Therapien beim HCC (modifiziert nach der BCLC Arbeitsgruppe5
Palliative Indikationsstellung der TACE
In der Literatur finden sich mehr als 60 randomisierte klinische Studien zur primären palliativen Therapie bei Patienten mit intermediärem HCC. Zusammenfassend zeigen diese Arbeiten, dass die TACE die einzige nicht-kurative Therapieform ist, die zu einer Überlebensverlängerung führt.5, 6 Die Ausschlusskriterien für eine palliative TACE sind relevante extrahepatische Tumormanifestationen und/oder eine verminderte Lebersynthesefunktion. Bei portaler Tumorinfiltration sollte eine superselektive Katheterisierung der Tumorarterien durchgeführt werden.7
Der wichtigste prognostische Faktor ist das Ansprechen des Tumors auf die Intervention. In der Studie von Uraki et al. kam es nach TACE bei mehr als 43% der Patienten zu einer 25%igen Reduktion der Tumorgröße und 1-, 3- und 5-Jahres-Überlebensraten von 42%, 11% und 3%.8 Die Effizienz der TACE hängt zusätzlich von folgenden Faktoren ab: Ausmaß der Embolisation, Vaskularisationsgrad der Tumoren und Tumorgröße. Diese verschiedenen Parameter erklären die Heterogenität der publizierten Ergebnisse mit 1-Jahr-Überlebensraten von 42% bis 99%, 2-Jahre-Überlebensraten von 16% bis 89% und 3-Jahre-Überlebensraten von 13% bis 77%.9 Heutzutage liegen keine Evidenzen weder bezüglich der Überlegenheit eines bestimmten Zytostatikas oder Embolisationsmaterials noch hinsichtlich der idealen Zeitabstände zwischen verschiedenen Therapiesitzungen vor.10
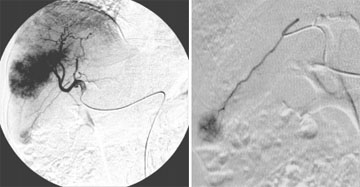
Abb. 1:
Angiographische Darstellung vor TACE.
1a) Selektive
Kathetesierung der Arteria hepatica dextra mit Darstellung eines infiltrativen
HCC im Segment 5 und 6. Weiter ist ein kleines enkapsulierten HCC im
Lebersegment 6 zu erkennen.
1b) Selektive
Positionierung eines Mikrokatheters in die tumorversorgende Arterie des
entkapsulierten HCCs.
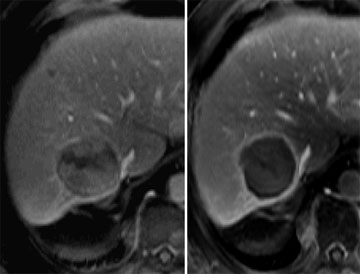
Abb. 2: FS-T1w-Aufnahme vor und nach perkutaner Radiofrequenz-Ablation.
2a) Solitäres enkapsuliertes HCC vor RFA
2b) Komplette Nekrose mit peripherem Granulationsgewebe nach erfolgreicher perkutaner RFA.
Radioembolisation
Der zelldestruierende Effekt der externen Bestrahlung unabhängig von der Histologie der Tumorzellen ist schon seit langem bewiesen. Die perkutane Strahlentherapie des HCC ist jedoch trotz technischer Weiterentwicklungen wie z.B. der stereotaktischen oder der 3D-Bestrahlung aufgrund der reduzierten Toleranz des zirrhotisch geänderten Leberparenchyms noch experimentell.
Bei der Radioembolisation werden dagegen radioaktive Mikrosphären in die Aa. hepatica dextra und sinistra selektiv injiziert. Bei dieser selektiven internen Radiotherapie (SIRT) wird meist 90Yttrium verwandt, ein Betastrahlen emittierendes Isotop mit einer physikalischen Halbwertzeit von 64,2 Stunden. Die Penetration im Gewebe beträgt durchschnittlich 2,5 mm. Der Vorteil dieser Therapie ist die Kombination einer hohen lokalen Strahlendosis im Tumorgewebe mit dem arteriellen Embolisationseffekt der Mikrosphären. Die durchschnittliche Dauer der Aktivität hängt von Tumorvolumen und Leberfunktion ab und beträgt im Mittel 3 GBq (0.8-5 GBq).11
Im Jahre 1998 berichteten Lau et al. über den Einsatz von 90Yttrium-Mikrosphären zur Behandlung nicht resektabler HCC bei 71 Patienten.12 Bei 19 von 71 Patienten wurde eine Tumorvolumenreduktion von über 50% erreicht. Bei 46 Patienten mit erhöhtem AFP (Alfa-Fetoprotein) vor Therapie zeigte sich in 89% der Fälle eine Reduktion des AFP-Levels nach bis zu fünf Therapiezyklen. Durch das erfolgreiche Downstaging konnte bei vier der 71 Patienten nach der Radioembolisation eine chirurgische Resektion durchgeführt werden. Sangro et al. berichteten über 24 Patienten mit HCC.13 Die applizierte Radioaktivität lag im Median bei 2,2 GBq mit einer medianen Strahlendosis für den Tumor von 106 Gy. Ein partielles Ansprechen (PR) wurde bei 90% der Patienten beobachtet, das mediane Überleben aller Patienten betrug sieben Monate. Als Nebenwirkungen wurden geringgradige Oberbauchschmerzen beobachtet. Allerdings verstarben zwei Patienten an einem strahleninduzierten Leberversagen. Ein Überlebensvorteil durch die Radioembolisation bei Patienten mit HCC ist bislang in großen randomisierten Studien noch nicht demonstriert.
Potenziell kurative bildgesteuerte Thermoablation
Die perkutane bildgesteuerte Tumorablation mittels thermischer
Verfahren stellt innerhalb der interventionellen Onkologie ein mittlerweile
etabliertes Verfahren für die Behandlung des HCC im Frühstadium dar. Prinzipiell
kann die thermische Energie mit unterschiedlichen Methoden appliziert werden.
Dazu gehören neben der Kryotherapie die Lasertherapie (LITT), der fokussierte
Ultraschall (FUS), die Mikrowellenablation (MWA) und die
Radiofrequenzablation (RFA). Die perkutane RFA
ist die am weitesten verbreitete Technik der lokalen Thermotherapie der Leber.
Die Erklärung dafür liegt in der Effektivität des Verfahrens bei der Zerstörung
von Tumorzellen verbunden mit einer niedrigen Komplikationsrate. Außerdem ist
der technische Aufwand der RFA im Vergleich zur Kryotherapie, der MWA oder der
LITT für die Behandlung von HCC deutlich geringer.14
Radiofrequenzablation
Funktionsprinzip
Das Prinzip der RFA beruht auf einem geschlossenen Stromkreislauf zwischen einem RF-Generator und dem Patienten. Die elektromagnetischen Radiofrequenz-Wellen werden von einem nadelähnlichen RF-Applikator in das Tumorgewebe emittiert. Der RF-Generator liefert einen sinusförmigen hochfrequenten Wechselstrom (375-480 kHz), der von der aktiven nicht isolierten Applikatorspitze in das umgebende Gewebe emittiert wird. Dieser Wechselstrom induziert eine intrazelluläre Ionenbewegung im Tumorgewebe mit der Folge einer fokalen Gewebeerhitzung. Die technologische Weiterentwicklung der verschiedenen RF-Systeme ermöglicht als Einzeltherapie oder in Kombination mit Embolisation die Therapie von HCC bis zu 6 cm. Derzeit gibt es mehrere von der amerikanischen FDA bzw. europäischen CE zugelassene Monopolar- und Multipolar-RF-Generatoren mit einer Leistung von 60 bis 250 Watt.15 Bildgebende Verfahren wie Computertomographie (CT) oder Magnetresonanztomographie (MRT) werden zur exakten Positionierung des aktiven RF-Applikators eingesetzt sowie zur Visualisierung und zum Monitoring der thermisch induzierten Veränderungen im Zielgewebe. Die Sonographie hat wegen der echoreichen Vaporisationsphänomene, die während der Energieapplikation beobachtet werden, für das Monitoring der RF-Ablation erhebliche Nachteile.16
Indikation
Zahlreiche Studien (Evidenz Ib) haben den Vorteil der Kombination einer Embolisation tumorversorgender Arterien vor einer RFA demonstriert.17 Die Leitlinien der Expertengruppe der Deutschen Gesellschaft für Interventionelle Radiologie (DeGIR) empfiehlt für die Behandlung von HCC zwischen 3-6 cm eine präoperative Embolisation.18 Allerdings ist der Anteil der kompletten Destruktion nach RFA im Falle enkapsulierter HCC per se größer als beim infiltrativen Tumortyp. Hierbei ist der thermische Isolationseffekt der Pseudokapsel von Bedeutung.
Komplikationen
Die Rate behandlungspflichtiger Komplikationen liegt im Mittel unter 2%. Reaktive Pleuraergüsse, Kapselhämatome und selten Infektionen sind die häufigsten Komplikationen. Lokale Schmerzen werden als Nebeneffekt während der RFA beobachtet und können weitergehende anästhesiologische Maßnahmen notwendig machen.
Klinische Ergebnisse
Seit dem ersten Bericht von Rossi et al. 199619 wurden mehr als 200 Arbeiten über die RFA primärer und sekundärer Lebertumore veröffentlicht. In dieser ersten Arbeit berichteten Rossi über 39 Patienten mit 41 HCC <3 cm, bei denen mit einem RF-Applikator in 95% der Fälle eine vollständige Tumornekrose erzielt wurde. Bei einem mittleren Beobachtungszeitraum von 23 Monaten kam es in 5% der Fälle zum lokalen Rezidiv.
Durch die Patientenselektion, die Weiterentwicklung der RFA und das bessere Verständnis der Funktionsprinzipien der RFA sind die klinischen Ergebnisse der RFA für das HCC mit denen der chirurgischen Resektion vergleichbar und bzgl. der Morbidität sogar überlegen. Chen et al.20 berichten in einer prospektiv randomisierten Studie von 180 Patienten mit solitärem HCC <5 cm, bei denen entweder eine RFA oder eine chirurgische Resektion durchgeführt wurde. Die Komplikationsrate war nach chirurgischer Resektion deutlich höher. Die 1-, 2-, 3- und 4-Jahresüberlebenszeit betrug nach RFA 96%, 82%, 71%, 68%, nach chirurgischer Resektion 93%, 82%, 73% und 64%. Das tumorfreie Überleben nach 4 Jahren betrug in der RFA-Gruppe 46% und in der chirurgischen Gruppe 52% ohne statistisch signifikante Unterschiede.
In einer weiteren Vergleichsstudie wurden 160 Patienten mit weniger als drei HCC <5 cm und Child-Pugh A eingeschlossen. Die Patienten erhielten entweder eine RFA oder eine chirurgische Resektion. Die lokale Rezidivrate betrug 9,8% nach chirurgischer Resektion und 18% nach RFA. Die 1-, 2- und 3-Jahresgesamtüberlebensraten waren nach RFA 96%, 87%, 80%, nach Chirurgie 98%, 87% und 77%.21 Hong et al. berichten in einer Vergleichsstudie bei 148 Patienten mit solitärem HCC <4 cm und Child-Pugh A über vergleichbare Ergebnisse der RFA und der chirurgischen Resektion im Hinblick auf die kumulative Überlebenszeit und das kumulative tumorfreie Überleben nach ein und drei Jahren. Allerdings war die lokale Rezidivrate in der RFA-Gruppe statistisch signifikant höher als in der chirurgischen Gruppe.22
Wahl des Zugangs
Die Wahl des Zugangs, ob perkutan oder intraoperativ, scheint für die Durchführung der RFA keinen Einfluss auf den klinischen Erfolg zu haben. Khan et al. berichteten von 228 Patienten mit kleinem (<3 cm, n=154) oder intermediärem (3,1-5 cm, n=73) HCC, die entweder perkutan oder intraoperativ mit RFA therapiert wurden. Für kleine HCC wurde eine komplette Ablation in 95% der Fälle für beide Verfahren beobachtet. Insgesamt waren die Komplikationsrate und die Dauer des stationären Aufenthaltes statistisch signifikant höher bei Patienten nach chirurgischer Resektion. Die 3-Jahresüberlebensrate betrug nach chirurgischer Resektion 57% und nach perkutaner RFA 71%. Bei Patienten mit HCC bis 5 cm Größe war die 3-Jahresüberlebensrate nach intraoperativer RFA 68% versus 42% nach perkutaner RFA.
Vergleich mit PEI
Im Vergleich der RFA mit der perkutanen Alkoholablation (PEI) wurde in zahlreichen unabhängigen Vergleichsstudien die Überlegenheit der RFA dokumentiert (Evidenz Ib). Diese Überlegenheit der RFA gegenüber der PEI wurde bereits 1999 nachgewiesen. Livraghi et al. behandelten 86 Patienten mit 112 HCC (n=52 mittels RFA und n=60 mittels PEI). Bei durchschnittlich 4,8 Sitzungen wurde durch die PEI in 80% eine vollständige Nekrose induziert, während bei durchschnittlich 1,2 Sitzungen durch die RFA in 90% eine vollständige Ablation erreicht wurde. Seit dieser Veröffentlichung haben weitere Vergleichsstudien die Überlegenheit der RFA gegenüber der PEI demonstriert. Seror et al. behandelten 57 Patienten mit 72 HCC mit PEI und 60 Patienten mit 72 HCC mit RFA und berücksichtigten dabei den Kostenaspekt. Die Patienten waren Child A mit HCC <3,5 cm. Die 2-Jahresüberlebensrate, das tumorfreie Überleben betrugen nach PEI 71% und 49% und nach RFA 91% und 71%. Durch die Anzahl der Sitzungen war die RFA mit ? 1,096 kostengünstiger als die PEI mit ? 1,534.25
Negative Prädiktoren
Negative prognostische Faktoren für die perkutane RFA von HCC sind die Tumorgröße (>5 cm), die Leberfunktion (Child-Pugh >6), die inkomplette Ablation mit Sicherheitsabstand, der Kontakt mit Gefäßen >3 mm, der AFP-Level (>100 ng/ml), die Anzahl der Tumoren (n>2), das Patientenalter (n>65 Jahren), AFP-L3 (>15%). Tumorlage und Zugangsweg spielen keine nennenswerte Rolle.
Auswahl der Methode
Der wichtigste Faktor bei der Therapieentscheidung beim HCC ist die korrekte Patientenselektion. Die TACE ist palliativ und führt zu einem Überlebensvorteil bei Patienten für die eine RFA nicht in Frage kommt, d.h. Patienten mit HCC im intermediären Stadium. Der „proof of principle“ der intraarteriellen Therapie wurde für dieses Stadium demonstriert. Eine Verbesserung der klinischen Ergebnisse ist mit der Weiterentwicklung der TACE z.B. mit medikamentenbeladenen Partikeln oder radioaktiven Mikrosphären zu erwarten.
Die kurativen Therapien des HCC sind Lebertransplantation, chirurgische Resektion und perkutane RFA. Bei Früh-HCC ohne Leberzirrhose sollte bei subkapsulärer Tumorlage die chirurgische Resektion bevorzugt werden. Aufgrund ihrer geringen Invasivität und der Möglichkeit der wiederholten Anwendung für vergleichsweise geringe Kosten stellt die RFA unter Schnittbildsteuerung die effektivste Methode dar. Offen ist dagegen noch, bei welcher Tumorgröße eine Kombinationstherapie oder eine adjuvante Therapie nach RFA sinnvoll ist.
1. Lo CM, Ngan H, Tso WK et al. Randomized controlled trial of transarterial lipiodol chemoembolization for unresectable hepatocellular carcinoma. Hepatology 2002; 35:1164-1171
2. Llovet J, Real MI, Montana X et al. Barcelona liver cancer group: arterial embolization or chemoembolization versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: a randomized controlled trial. Lancet 2002; 359:1734-1739
3. Lewis AL, Gonzales AV, Lloyd AW et al. DC Bead: in vitro characterization of a drug-delivery device for transarterial chemoembolization. J Vasc Interv Radiol 2006; 17:335-342
4. Sakomoto I, Nobuya A, Nagaoki K et al. Complications associated with transarterial chemoembolization for hepatic tumors. Radiographics 1998; 18:605-619.
5. Bruix J, Hessheimer AJ, Forner A, Boix L, Vilana R, Llovet JM. New aspects of diagnosis and therapy of hepatocellular carcinoma. Oncogene 2006; 25:3848-3856
6. Llovet JM, Bruix J. Systemic review of randomized trials for unresectable hepatocellular carcinoma: chemoem-bolization improves survival. Hepatology 2003; 37:429-442
7. Kim JH, Yoon HK, Kim SY et al. Transarterial chemoembolization versus chemoinfusion for unresectable hepatocellular carcinoma in patients with major portal vein thrombosis. Aliment Pharmacol Ther 2009; Apr; [Web pub]
8. Uraki J, Yamakado K, Nakatsuka A et al. Transcatheter hepatic arterial chemoembolization for hepatocellular carcinoma invading the portal veins: therapeutic effects and prognostic factors. Eur J Radiol 2004; 51:12-18
9. Vogl TJ, Zangos S, Balzer JO et al. Transarterielle Chemoembolisation (TACE) des hepatozellulären Karzinoms: Technik, Indikationsstellung und Ergebnisse. Fortschr Röntgenstr 2007; 179: 1113-1126
10. Marelli L, Stigliano R, Triantos C et al. Transarterial therapy for hepatocellular carcinoma: which technique is more effective? A systematic review of cohort and randomized studies. Cardiovasc Intervent Radiol 2007; 30:6-25
11. Jakobs TF, Hoffmann RT, Tatsch K, Trumm C, Reiser MF. Therapieresponse von Lebertumoren nach selektiver interner Radiotherapie. Radiologe 2008;
12. Lau WY, Ho S, Leung WT et al. Selective internal radiation therapy for non resectable hepatocellular carcinoma with intraarterial infusion von 90-yttrium microspheres. Int J Radiat Oncol Biol Phys 1998; 40:583-592
13. Sangro B, Bilbao JI, Boan J et al. Radioembolization using Y90-microspheres for patients with advanced hepatocellular carcinoma. Int J Radiat Oncol Biol Phys 2006; 66:792-800
14. Pereira PL, Trübenbach J, Schmidt D. [Radiofrequency Ablation: Basic principles, Techniques and Challenges]. Fortschr Röntgenstr 2003; 175:20-27
15. Pereira PL, Trübenbach J, Schenk M, et al. Radiofrequency ablation: in vivo comparison of four commercially available devices in pig livers. Radiology 2004; 232(2):482-490
16. Leyendecker JR, Dodd GD, Halff GA et al. Sonographically observed echogenic response during intraoperative radiofrequency ablation of cirrhotic livers. Am J Roentgenol 2002; 178:1147-1151
17. Yamakado K, Nakatsuka A, Takaki H et al. Early-Stage Hepatocellular Carcinoma: Radiofrequency Ablation Combined with Chemoembolization versus Hepatectomy. Radiology 2008; 249:718-719
18. Pereira PL, Düx M, Helmberger T et al. Perkutane bildgesteuerte Lebertumortherapie mittels RFA. Leitlinien der Deutschen Gesellschaft für Interventionelle Radiologie. Brennpunkt Fortschr Röntgenstr 2009.
19. Rossi S, DiStasi M, Buscarini E et al. Percutaneous RF interstitial thermal ablation in the treatment of hepatic cancer. Am J Reontgenol 1996; 167:759-768
20. Chen MS, Li JQ, Zheng Y et al. A prospective randomized trial comparing percutaneous local ablative therapy and partial hepatectomy for small hepatocellular carcinoma. Ann Surg 2006; 243:321-328
21. Cho CM, Tak WY, Kweon YO et al. The comparative results of radiofrequency ablation versus surgical resection for the treatment of hepatocellular carcinoma. Korean J Hepatol 2005; 11:59-71
22. Hong SN, Lee SY, Choi MS et al. Comparing the outcomes of radiofrequency ablation and surgery in patients with a single small hepatocellular carcinoma and well preserved hepatic function. J Clin Gastroenterol 2005; 39:247-252
23. Khan MR, Poon RT, Ng KK et al. Comparison of percutaneous and surgical approaches for radiofrequency ablation of small and medium hepatocellular carcinoma. Arch Surg 2007; 142:1136-1143
24. Livraghi T, Goldberg SN, Lazzaroni S et al. Small hepatocellular carcinoma: treatment with radiofrequency ablation versus ethanol injection. Radiology 1999; 210:655-661.
25. Seror O, N’Kontchou G, Tin Tin Htar et al. Ethanol versus radiofrequency ablation for the treatment of small hepatocellular carcinoma in patients with cirrhosis. Gastroenterol Clin Biol 2006; 30:1265-1273





