Simeprevir (Olysio®)
150 mg Hartkapsel
Indikation
Fachinformation/Zusammenfassung der Merkmale des Arzneimittels
Siehe auch: G-BA Beschluss zu Simprevir
Simeprevir ist bei erwachsenen Patienten in Kombination mit anderen Arzneimitteln zur Behandlung der chronischen Hepatitis C (CHC) indiziert (siehe Abschnitte 4.2, 4.4 und 5.1).
Für die Hepatitis-C-Virus (HCV)-genotypspezifische Aktivität, siehe Abschnitte 4.4 und 5.1.
Tabelle 1: Empfohlene Arzneimittel und Therapiedauer im Rahmen der Kombinationstherapie mit OLYSIO
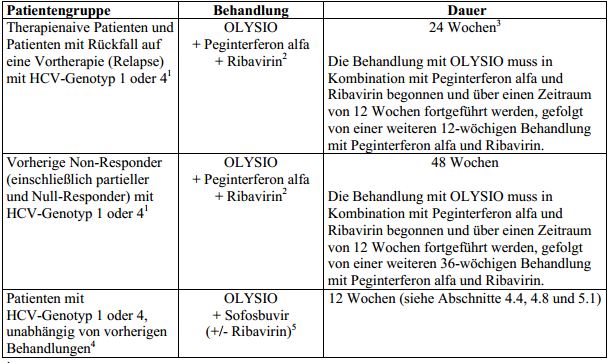
1 Einschließlich Patienten mit oder ohne Zirrhose und mit dem humanen Immundefizienzvirus (HIV) koinfizierte Patienten. Relapse oder Non-Response nach Vortherapie mit Interferon (pegyliert oder nicht pegyliert), mit oder ohne Ribavirin (siehe Abschnitt 5.1).
2 Wird eine Therapie mit OLYSIO, Peginterferon alfa und Ribavirin bei Patienten mit HCV-Genotyp 1a erwogen, soll vor Behandlungsbeginn eine Untersuchung auf einen NS3-Q80K-Polymorphismus durchgeführt werden (siehe Abschnitt 4.4).
3 Therapienaive Patienten und vorherige Relapser mit Zirrhose und HIV-Koinfektion sollten 48 Wochen behandelt werden. Die Therapie mit OLYSIO muss in Kombination mit Peginterferon alfa und Ribavirin über einen Zeitraum von 12 Wochen eingeleitet werden, gefolgt von einer weiteren 36-wöchigen Behandlung mit Peginterferon alfa und Ribavirin. Siehe „Besondere Patientengruppen -HCV/HIV-1(humanes Immundefizienzvirus Typ 1)-Koinfektion“.
4 Einschließlich therapienaiven Patienten oder Patienten mit vorherigem Therapieversagen unter Peginterferon alfa und Ribavirin, mit oder ohne Zirrhose.
5 OLYSIO in Kombination mit Sofosbuvir sollte nur bei Patienten angewendet werden, bei denen Interferon nicht geeignet ist oder die es nicht vertragen und bei denen eine Behandlung dringend ist. Basierend auf einer klinischen Bewertung jedes einzelnen Patienten kann Ribavirin hinzugefügt werden (siehe Abschnitte 4.4, 4.8 und 5.1). Die empfohlene Behandlungsdauer beträgt 12 Wochen. Eine längere Behandlungsdauer mit OLYSIO zusammen mit Sofosbuvir (mit oder ohne Ribavirin) (bis zu 24 Wochen) kann im Einzelfall in Betracht gezogen werden (siehe Abschnitte 4.4, 4.8 und 5.1).
Kombination mit Sofosbuvir ohne Interferon
Simeprevir in Kombination mit Sofosbuvir sollte nur bei Patienten angewendet werden, bei denen Interferon nicht geeignet ist oder die es nicht vertragen und bei denen eine Behandlung dringend ist. Basierend auf einer klinischen Bewertung jedes einzelnen Patienten kann Ribavirin hinzugefügt werden (siehe Abschnitte 4.4, 4.8 und 5.1). Die empfohlene Behandlungsdauer beträgt 12 Wochen. Eine längere Behandlungsdauer mit OLYSIO zusammen mit Sofosbuvir (mit oder ohne Ribavirin) (bis zu 24 Wochen) kann im Einzelfall in Betracht gezogen werden (siehe Abschnitte 4.4, 4.8 und 5.1).
Anwendung bei Genotyp 1a
Die Wirksamkeit von Simeprevir in Kombination mit Peginterferon alfa und Ribavirin ist bei Patienten mit Hepatitis-C-Infektion vom Genotyp 1a mit NS3-Q80K-Polymorphismus bei Therapiebeginn deutlich geringer als bei Patienten mit Hepatitis-C-Infektion vom Genotyp 1a ohne Q80K-Polymorphismus (siehe Abschnitt 5.1). Daher wird ein Screening auf Q80K-Polymorphismus bei Patienten mit HCV-Genotyp 1a dringend empfohlen, wenn eine Therapie mit Simeprevir in Kombination mit Peginterferon alfa und Ribavirin geplant wird. Bei Patienten mit HCV-Genotyp 1a und nachgewiesenem Q80K-Polymorphismus oder Nichtdurchführbarkeit des Screenings ist eine Alternativtherapie in Erwägung zu ziehen.
Aufgrund limitierter Daten kann noch nicht beurteilt werden, ob ein Q80K-Polymorphismus bei Patienten mit HCV-Genotyp 1a die Wirksamkeit von Simeprevir reduziert, wenn Simeprevir in Kombination mit anderen direkt wirkenden antiviralen HCV-Arzneimitteln verabreicht wird (siehe Abschnitt 5.1). Bis zum Vorliegen konfirmatorischer Daten soll bei Patienten mit HCV-Genotyp 1a und geplanter Behandlung mit Simeprevir in Kombination mit Sofosbuvir eine Untersuchung zum Ausschluss eines Q80K-Polymorphismus in Betracht gezogen werden.
Dosierung
150 mg täglich zusammen mit Nahrung.
Wechelwirkungen
Die gemeinsame Anwendung von Simeprevir mit Wirkstoffen, die Cytochrom P450 3A4 (CYP3A4) mäßig oder stark induzieren oder hemmen, wird nicht empfohlen, da dies zu signifikant niedrigeren oder höheren Simeprevir-Expositionen führen könnte.
Verträglichkeit
Die Verträglichkeit ist gut. Photosensitivitätsreaktionen, Dyspnoe, Anstieg von Bilirubin sowie Hautausschläge wurden beobachtet.
Wirksamkeit
Simeprevir + pegIFN/RBV
Tabelle 8: SVR12-Raten1, aufgeschlüsselt nach HCV-Geno-/-Subtyp und Vorliegen oder Fehlen
eines Q80K-Polymorphismus bei Studienbeginn, bei mit Simeprevir/Placebo in Kombination mit
Peginterferon alfa und Ribavirin behandelten HCV-Genotyp-1-Patienten (Intent-To-Treat-Analyse)
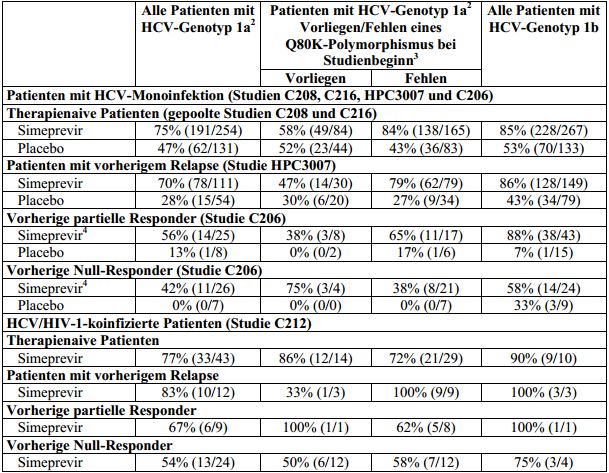
1 SVR24 für Studie C206.
2 Kann einige Patienten mit anderem Genotyp als HCV-Genotyp 1a/1b einschließen.
3 Anzahl der Patienten in der Simeprevir-Behandlungsgruppe: nur Patienten mit verfügbaren Sequenzdaten.
4 Gepoolte 150-mg-Simeprevir-Behandlungsgruppe.
Hinweis: In den Studien C208, C216, HPC3007 und C206 hatten drei HCV-Genotyp-1b-infizierte Patienten bei Studienbeginn einen Q80K-Polymorphismus. Alle drei Patienten hatten eine SVR12.
SVR12/24: dauerhaftes virologisches Ansprechen 12/24 Wochen nach dem geplanten Behandlungsende.
Tabelle 9: Behandlungsergebnis bei therapienaiven erwachsenen Patienten mit HCV-Genotyp-1-Infektion (gepoolte Daten aus den Studien C208 und C216; Intent-To-Treat-Analyse)
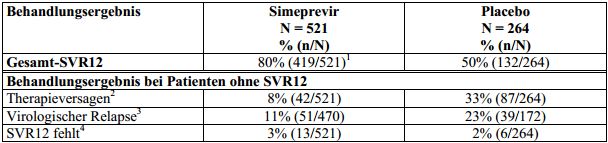
Simeprevir: 150 mg Simeprevir für 12 Wochen zusammen mit Peginterferon alfa-2a oder -2b und Ribavirin für 24 oder
48 Wochen; Placebo: Placebo für 12 Wochen zusammen mit Peginterferon alfa-2a oder -2b und Ribavirin für 48 Wochen.
SVR12: dauerhaftes virologisches Ansprechen 12 Wochen nach dem geplanten Behandlungsende.
1 p < 0,001
2 Therapieversagen während der Behandlung war wie folgt definiert: Anteil der Patienten mit bestätigter nachweisbarer HCV-RNA am Behandlungsende (einschließlich von, aber nicht beschränkt auf Patienten, die die im Protokoll definierten Abbruchkriterien erfüllten und/oder einen virologischen Durchbruch erlitten).
3 Bei der Berechnung der virologischen Relapse-Raten repräsentierte der Nenner die Anzahl der Patienten ohnenachweisbare HCV-RNA beim tatsächlichen Behandlungsende. Eingeschlossen sind 4 mit Simeprevir behandelte Patienten, bei denen es nach SVR12 zu einem Relapse kam.
4 Patienten mit fehlenden Daten zum Zeitpunkt der SVR-Bewertung.
Tabelle 10: SVR12-Raten, aufgeschlüsselt nach METAVIR-Fibrosestadium und IL28B-Genotyp, bei
therapienaiven erwachsenen Patienten mit HCV-Genotyp-1-Infektion (gepoolte Daten aus den
Studien C208 und C216; Intent-To-Treat-Analyse)
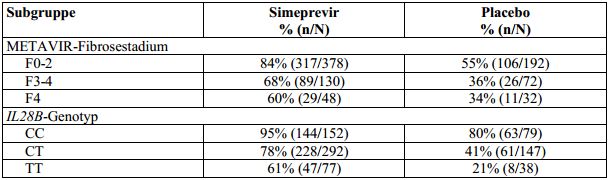
Simeprevir: 150 mg Simeprevir für 12 Wochen zusammen mit Peginterferon alfa-2a oder -2b und Ribavirin für 24 oder
48 Wochen; Placebo: Placebo für 12 Wochen zusammen mit Peginterferon alfa-2a oder -2b und Ribavirin für 48 Wochen.
SVR12: dauerhaftes virologisches Ansprechen 12 Wochen nach dem geplanten Behandlungsende.
Simeprevir/Sofosbuvir
Tabelle 17: Behandlungsergebnis bei erwachsenen Patienten mit HCV-Genotyp-1-Infektion, die
Null-Responder auf eine vorherige Therapie mit Peginterferon alfa und Ribavirin oder die
therapienaiv waren und die eine 12-wöchige Simeprevir-Kombinationstherapie mit Sofosbuvir mit
oder ohne Ribavirin erhielten (Studie HPC2002; Intent-To-Treat-Analyse)
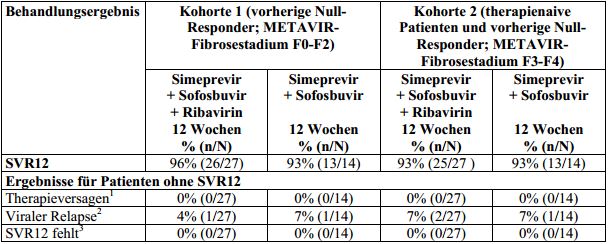
150 mg Simeprevir einmal täglich für 12 Wochen zusammen mit 400 mg Sofosbuvir einmal täglich mit oder ohne
Ribavirin. SVR12: anhaltendes virologisches Ansprechen 12 Wochen nach dem geplanten Behandlungsende.
1 Therapieversagen war wie folgt definiert: Anteil der Patienten mit bestätigter nachweisbarer HCV-RNA am
Behandlungsende (einschließlich von, aber nicht beschränkt auf Patienten, die die im Protokoll definierten
Abbruchkriterien erfüllten).
2 Bei der Berechnung der virologischen Relapse-Raten repräsentierte der Nenner die Anzahl der Patienten mit nicht
nachweisbarer HCV-RNA bei Behandlungsende und mindestens einer HCV-RNA-Bestimmung während der
Nachbeobachtung.
3 Patienten mit fehlenden Daten zum Zeitpunkt der SVR-Bewertung.
Tabelle 18: SVR12-Raten bei erwachsenen Patienten mit HCV-Genotyp-1-Infektion, die NullResponder auf eine Vorbehandlung mit Peginterferon alfa und Ribavirin oder nicht vorbehandelt
waren, aufgeschlüsselt nach Genotyp/Subtyp und Q80K-Polymorphismus bei Studienbeginn
(Studie HPC2002; Intent-To-Treat-Analyse)
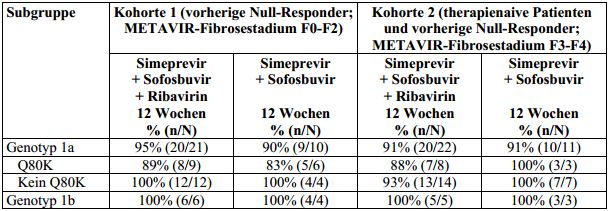
150 mg Simeprevir einmal täglich über 12 Wochen in Kombination mit 400 mg Sofosbuvir einmal täglich mit oder ohne
Ribavirin. SVR12: anhaltendes virologisches Ansprechen 12 Wochen nach dem geplanten Behandlungsende
Kreuzresistenz
Es wurde gezeigt, dass einige der unter der Behandlung mit Simeprevir aufgetretenen Aminosäuresubstitutionen in NS3 bei Patienten, die in klinischen Studien keine SVR erreichten (z. B. R155K), die Anti-HCV-Aktivität von Telaprevir, Boceprevir und anderen NS3/4A-PIs reduzieren. Welche Auswirkungen eine frühere Exposition gegenüber Simeprevir bei Patienten ohne Erreichen einer SVR auf die Wirksamkeit späterer Behandlungsschemata auf der Basis von HCV-NS3/4A-PIs hat, wurde nicht untersucht. Es liegen keine klinischen Daten zur Wirksamkeit von Simeprevir bei Patienten mit früherer Exposition gegenüber den NS3/4A-PIs Telaprevir oder Boceprevir vor.
Bewertung/Einordnung/Nutzen
Der Proteasehemmer Simeprevir ist deutlich einfacher einzunehmen und besser verträglich als sein Vorgänger Telaprevir. In Kombination mit Interferon sollte bei GT1a der Polymorphismus Q80K ausgeschlossen werden; bei Vorbehandlung mit Telaprevir besteht die Gefahr der Kreuzresistenz. Die Interferon-freie Kombination Sofosbuvir+Simeprevir ist nur bei Interferon-Unverträglichkeit bzw. –Kontraindikation und gleichzeitig dringlicher Therapieindikation zugelassen.
Die hier genannten Informationen wurden gewissenhaft erstellt. Eine Gewähr für die Richtigkeit der gemachten Angaben kann trotz aller Bemühungen NICHT übernommen werden!





