SPRINT: Hohe SVR-Raten mit Boceprevir
Die Triple-Therapie mit dem Proteasehemmer Boceprevir verdoppelt nahezu die
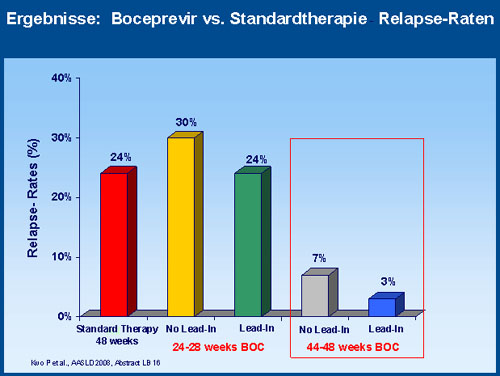
SVR-Rate im Vergleich zur Standardtherapie (75% vs. 38%). Die Relapse-Raten unter der neuen Kombination
betrugen ohne Lead-in 7% und mit Lead-in 3% im Vergleich zu 24% bei konventioneller Behandlung.
In der Studie SPRINT-1 wurde die Wirksamkeit und Sicherheit des Proteasehemmers Boceprevir in
Kombination mit pegyliertem Interferon alfa-2b und Ribavirin untersucht. Weitere Ziele waren die
Untersuchung einer Lead-in-Phase, der Ribavirin-Dosis sowie des prädiktiven Wertes von RVR und EVR.
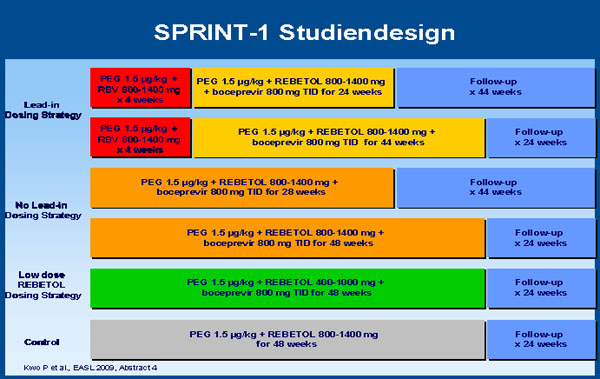
Studiendesign
- In dem komplexen Studiendesign die konventionelle Therapie PegIFN/RBV(800-1400 mg/d) für 48 Wochen mit fünf Boceprevir(800 mg TID)-Regimen verglichen:
- 4 Wochen pegIFN/RBV Lead-in gefolgt von pegIFN/RBV (800-1400 mg/day)/ Boceprevir für 24 oder 44 Wochen
- pegIFN/RBV(800-1400 mg/d)/Boceprevir für 28 oder 48 Wochen
- pegIFN/niedrig dosiertes RBV(400-1000 mg/d)/Boceprevir für 48 weeks
Primärer Endpunkt war die SVR (sustained virologic response) zu Woche 24 nach Therapieende (Roche TaqMan LLD=15 IU/mL)
An der Studie nahmen 595 therapienaive Patienten mit chronischer Hepatitis C Genotyp 1 teil. 60% waren Männer, 7% hatten eine Zirrhose, 90% hatten eine HCVL >600.000 IU/ml.
RVR-Zeitpunkt – 4 Wochen nach Therapiebeginn mit Boceprevir.
Ergebnisse
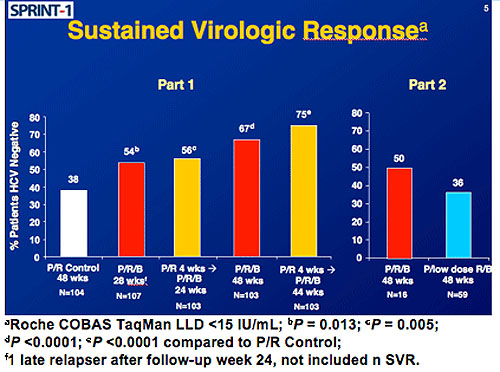
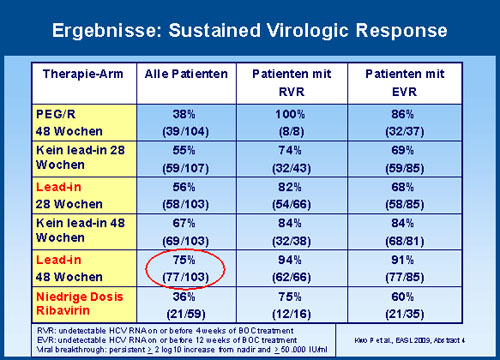
Am besten schnitt die Gruppe mit Lead-in-Phase gefolgt von 48 Wochen Triple-Therapie ab. Hier erreichten
insgesamt 75% der Patienten eine SVR im Vergleich zu insgesamt 38% unter Standardtherapie. Bei 48 Wochen
ohne Lead-in waren es 67% und mit weniger Ribavirin gar nur 36%.
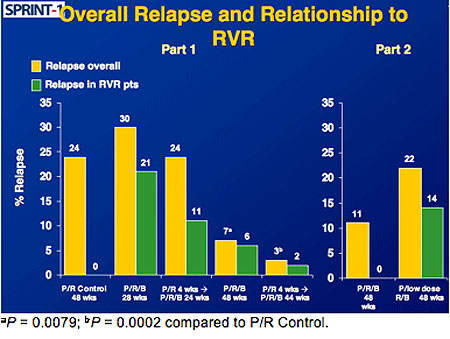
Die Lead-in Phase vermindert das Risiko des Relapses von 24% unter Standardtherapie auf 3% mit Lead-in
und 7% ohne Lead-in, wobei die Relapse-Rate bei Patienten ohne RVR höher war.
Verträglichkeit
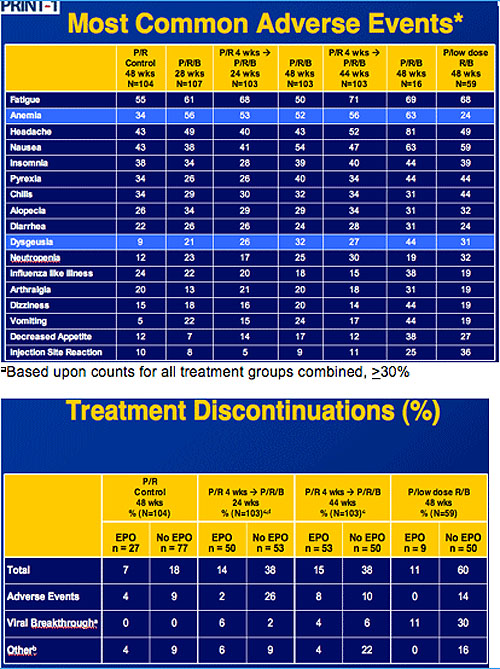
Die Verträglichkeit der Triple-Kombination war im Allgemeinen gut. Die häufigsten
Nebenwirkungen unter Boceprevir waren Müdigkeit, Anämie, Kopfschmerzen und Übelkeit.
Boceprevir führte zu einer weiteren Verminderung des Hämoglobins um im Schnitt 1g/dl. Die Gabe
von Erythropoietin verminderte die Abbruchrate wegen Anämie.
Fazit
- Die Triple-Therapie mit Boceprevir plus Lead-in verdoppelt nahezu die SVR-Raten im Vergleich zur Standardtherapie
- Eine Lead-in Phase vermindert das Risiko eines viralen Durchbruchs.






