PROVE 3: Telaprevir bei Relapse und Nonresponse
In dieser schwierig zu behandelnden Gruppe waren 73% der Relapser und 41% der Nonresponder 12 Wochen nach einer Telaprevir-basierten Therapie noch Virus-frei.
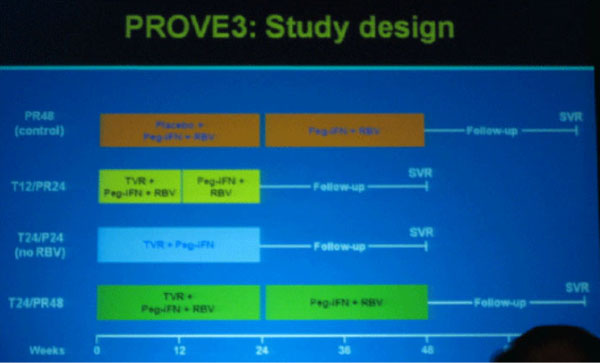
In der Phase-2b-Studie PROVE-3 werden 453 Patienten mit HCV Genotyp 1, die auf eine Standardtherapie mit
pegIFN/RBV nicht angesprochen bzw. einen Relaps erlitten haben, nach Randomisierung erneut behandelt und
zwar in folgenden Armen:
* PR: pegIFN/RBV 48 Wochen
* T12/PR24: TVR/pegIFN/RBV 12 Wochen plus pegIFN/RBV 12 Wochen
* T24/P24: TVR/peg/IFN 24 Wochen
* T24/PR48: TVR/pegIFN/RBV 24 Wochen plus pegIFN/RBV 24 Wochen
Die Therapie wurde abgebrochen bei einem virologischen Durchbruch definiert als Anstieg der HCV-RNA = 1 log10 vom Nadir oder HCV-RNA >100 IU/ml bei vorher nicht nachweisbarer Viruslast.
Ergebnisse
Präsentiert wurden die Ergebnisse der geplanten Interim-Analyse zu Woche 36.
Die endgültigen SVR-Raten liegen somit noch nicht vor. 12 Wochen nach Therapieende waren jedoch 73% der früheren Relapser und 41% der früheren Nonresponder nach 12 Wochen 3er-Kombination und 24 Wochen Standardtherapie Virus-frei.
| 12W TPV/pegIFN/RBV + 24 W pepIFN/RBV (n=115) |
24WTPV/pegIFN/RBV (n=111) |
|
| SVR12 (%) | 52 | 21 |
| Non-Resonder | 41 | 11 |
| Relapser | 73 | 46 |
| Virologischer Durchbruch | 44 | 20 |
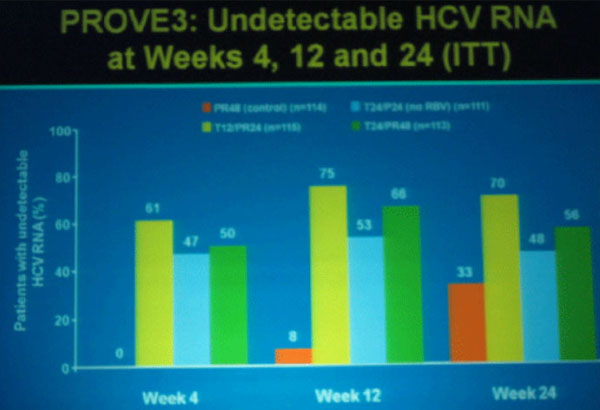
Insgesamt hatten mehr Patienten auf eine Telaprevir-basierte Re-Therapie angesprochen und waren zu Woche 4, 12 und 24 HVC-RNA negativ.
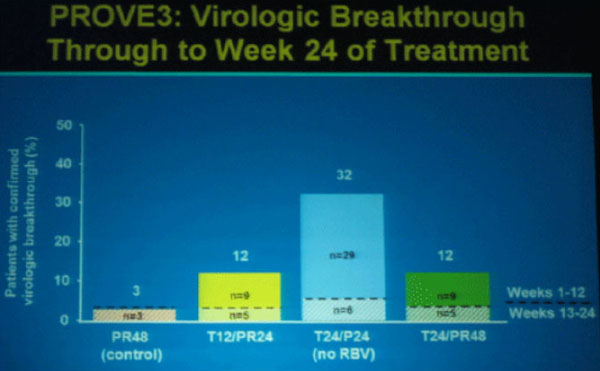
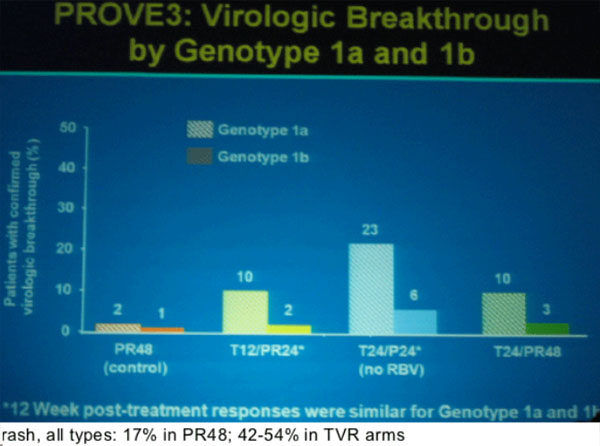
In der Gruppe ohne Ribavirin kam es allerdings - wie schon in den Studien PROVE 1 und 2 - am häufigsten (32%) zum virologischen Durchbruch.
Verträglichkeit
Abgesehen von den üblichen Nebenwirkungen unter pegIFN/RBV kam es unter Telaprevir häufiger zu Hautproblemen (Ausschlag, Juckreiz) und mehr Patienten brachen die Therapie ab als unter der Standardbehandlung (16% vs. 4%).





