Thomas Berg, Leipzig
Response-gesteuerte Therapie mit Proteaseinhibitoren
Der Erfolg einer Interferon alpha
(pegIFN)-basierten Kombinationstherapie bei chronischer Hepatitis C wird
maßgeblich von viralen Faktoren (z.B. HCV-Genotyp und initialer Viruslast), von
epidemiologischen, klinischen und genetischen Wirtsfaktoren (z.B. Dauer der
Infektion, Alter, Geschlecht, Ethnizität des Patienten, Ausmaß der hepatischen
Fibrose) sowie dem Interleukin 28B (IL28B)-Genotyp beeinflusst. Die frühe
Viruskinetik nach Therapiebeginn gibt Aufschluss über die individuelle
Therapie-Suszeptibilität und spielt daher eine entscheidende Rolle bei der
Planung der Therapiedauer („Response-gesteuerte Therapie“). Hierbei hat sich
insbesondere die rasche und komplette Suppression der Hepatitis C-Virämie unter
die Nachweisgrenze sensitiver Tests innerhalb der ersten 4 Wochen nach
Therapiebeginn (rapid virological response, RVR) als wichtigster positiver
prädiktiver Parameter für einen anhaltenden Therapieerfolg (sustained
virological response, SVR) etabliert. Bei langsamem Abfall der Viruslast nach
12 bzw. 24 Wochen ist dagegen das Risiko für einen Relapse hoch. 1-3 Eine individualisierte Therapiestrategie, die die jeweils vorhandenen
prädiktiven Faktoren für jeden Patienten berücksichtigt, stellt ein wichtiges
Ziel auch für die zukünftige Optimierung dieser nebenwirkungsreichen und
kostenintensiven Therapie dar. 1-5 Für die duale
Therapie mit pegIFN plus Ribavirin sind inzwischen in Abhängigkeit vom
HCV-Genotyp Therapiedauern von 16-72 Wochen etabliert 1-5 (Abb. 1).
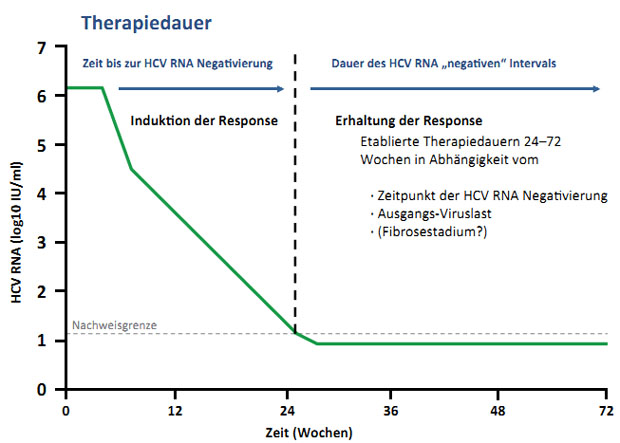
Abbildung 1: Bisheriges Konzept der Response-gesteuerten Therapie. In Abhängigkeit von der Geschwindigkeit der Induktion einen virologischen Response wird eine Erhaltungsthera-piedauer festgelegt. Dabei gilt: je rascher die Response, desto kürzer die Erhaltungsthera-piedauer und vice versa.
Abbildung 1: Bisheriges Konzept der Response-gesteuerten Therapie. In Abhängigkeit von der Geschwindigkeit der Induktion einen virologischen Response wird eine Erhaltungsthera-piedauer festgelegt. Dabei gilt: je rascher die Response, desto kürzer die Erhaltungsthera-piedauer und vice versa.
Prädiktoren bei Tripletherapie
Für den Erfolg der Tripletherapie ist ein zumindest partielles Ansprechen auf die duale Kombinationstherapie mit pegIFN/RBV von zentraler Bedeutung, da sonst das Risiko einer funktionellen Proteaseinhibitior-Monotherapie besteht. Daraus ergibt sich, dass prinzipiell alle bis-her bekannten Faktoren, die einen Einfluss auf die individuelle Interferon-Suszeptibiliät besitzen, auch Einfluss auf das Ansprechen auf die Tripletherapie haben können.
Bei der Prädiktion der SVR im Rahmen der
dualen pegIFN plus Ribavirin-Therapie kann man Faktoren unterscheiden, die vor
allem die Nonresponse- oder Relapse-Rate beeinflussen. Eine hohe GGT stellt zum
Beispiel einen typischen Nonresponse-Marker dar, während das Alter eher mit dem
Relapserisiko assoziiert ist. 6 (Abb. 2)
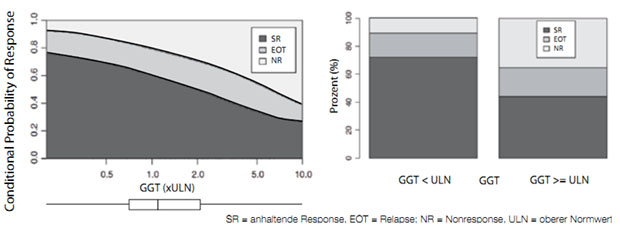
Abbildung 2: Bedeutung der GGT-Kontentrationen für das Ansprechen auf eine duale Kombinationstherapie. Es zeigt sich eine nahezu lineare Korrelation zwischen GGT-Konzentration und Nonresponse-Rate. Die Relapserate wird durch die GGT nicht beeinflusst (nach 6)
Abbildung 2: Bedeutung der GGT-Kontentrationen für das Ansprechen auf eine duale Kombinationstherapie. Es zeigt sich eine nahezu lineare Korrelation zwischen GGT-Konzentration und Nonresponse-Rate. Die Relapserate wird durch die GGT nicht beeinflusst (nach 6)
Auf der Tagung der AASLD 2011 wurden erstmals umfassende Analysen zur Bedeutung von Baseline-Prädiktoren für die Heilungschancen unter Tripletherapie vorgestellt. 7,8 Folgende Faktoren waren bei vorbehandelten Patienten in der REALIZE-Studie mit Telaprevir in der univariaten Analyse signifikant mit der SVR assoziiert: niedrige LDL-Konzentration, niedriger Fibrosestatus, niedrige HCV-RNA, niedrige GGT, niedrige ALT und der HCV-Subtyp 1b. In der multiviariaten Analyse blieben nur noch die LDL-Konzentration und der HCV-Subtyp statistisch signifikant. 7
Bei unvorbehandelten Patienten, die eine Tripletherapie mit dem Proteaseinhibitor BI201335 erhalten hatten (SILEN-C), korrelierte in der multivariaten Analyse ausschließlich die GGT-Konzentration signifikant mit der SVR (OR 3.7). Die SVR-Raten lagen in der Kontrollgruppe (duale Therapie) bei normaler vs. erhöhter GGT bei 67 % vs. 39 % und in der Proteaseinhibitor-basierten Tripletherapie bei 91 % vs. 72 %. 8
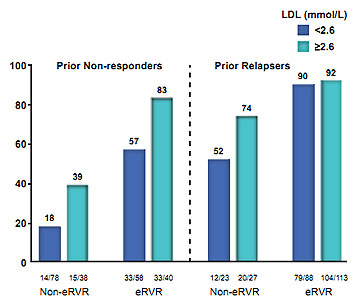
Abbildung 3: SVR-Raten bei vorbehandelten Patienten unter Telaprevir-Tripletherapie in Abhängigkeit von der Response auf die Vortherapie, eRVR und LDL-Konzentration zu Baseline (nach 7).
| ilb 28 genotyp (rs12979860) | Woche 4 HCV rnA Abfall ≥1 log10 | Woche 4 HCV rnA Abfall<1 log10 | P-value |
|---|---|---|---|
| CC | 396 (98 %) | 8 (2 %) | <0.001 |
| CC |
392 (71 %) | 164 (30 %) | |
| TT |
70 (54 %) | 59 (46 %) |
Tabelle 1: Wahrscheinlichkeit des Therapieansprechens auf eine 4-wöchige Lead-in Phase mit dualer Therapie in Abhängigkeit vom IL28B-Status. Evaluation der Daten aus der IDEAL-Studie. Die Ergebnisse belegen, dass bei homozygoten Trägern des IL28B Responder-Allels (rs12979860 CC) mit nahezu 100% von einer Response in der Lead-in Therapie von mehr als einer log-Stufe ausgegangen werde kann (nach 11)
Diese Untersuchungen bestätigen, dass bisher bekannte Response-Prädiktoren auch unter Tripletherapie weiterhin das Therapieansprechen beeinflussen können. Durch die deutliche Steigerung der antiviralen Effektivität der Proteaseinhibitor-basierten Tripletherapie nimmt jedoch die Bedeutung der bekannten Prädiktoren ab. Das bedeutet, dass das Ausmaß, mit welchem der Prädiktor die SVR-Rate beeinflusst, bei der Triple-Therapie im Vergleich zur dualen Therapie deutlich geringer ausgeprägt ist.
Interessant sind auch die Ergebnisse zur Bedeutung der LDL-Konzentration. Eine Risikostratifizierung anhand der LDL-Konzentration ist selbstunter Einbeziehung der Response auf die Vorbehandlung sowie dem RVR Status möglich (Abb. 3). Einer neuen Studie von Li und Kollegen zufolge könnte der Einfluss des IL28B-Polymorphismus auf den endogenen Cholesterol-Metabolismus, der nach unserem bisherigen Kenntnisstand eng mit dem HCV-Lebenszyklus assoziiert ist, für die beobachtete Assoziation von LDL-Cholesterin und SVR eine Rolle spielen. 9
Zusätzlich ist der Subtyp HCV-1a mit höheren Resistenz- und niedrigeren Heilungsraten assoziiert. Dieser Befund wird durch die unterschiedlich hohe „Resistenz-Barriere“ der beiden Subtypen gegenüber Proteaseinhibitoren erklärt (siehe „HCV-Resistenz unter Proteaseinibitoren“, Kai-Henrik Peiffer, Christoph Sarrazin, Seite 14).
Bedeutung von IL28B
Die signifikante Bedeutung des IL28B Genotyps
für die individuelle IFNa-Suszeptibilität lässt sich eindeutig anhand der
frühen viralen Kinetik unter Therapie ablesen. 10 Patienten mit einem IL28B rs12979860 C/C-Responder-Genotyp zeigen
einen rascheren Abfall der Viruslast und erreichen damit deutlich häufiger eine
RVR als Patienten mit dem Nonresponder T-Allel 10,11 (siehe Tab. 1). Insgesamt besteht daher wie bei der Standardkombinationstherapie
auch bei Tripletherapie eine Korrelation zwischen dem IL28B-Genotyp
(rs12979860) und der Wahrscheinlichkeit einer SVR. 12-14 Allerdings ist der Effekt des IL28B-Genotyps auf die Heilungsrate
unter Triple-therapie geringer ausgeprägt als unter der
pegInterferon/Ribavirin-Kombinationstherapie. Die Daten der ADVANCE-Studie mit
Telaprevir lassen jedoch vermuten, dass der IL28B-Genotyp auch zur Steuerung
der Dauer einer Tripletherapie herangezogen werden könnte. Bei homozygoten Trägern
des IL28B-Responder-Allels (rs12979860 CC) betrugen die SVR-Raten 90 % und 87 % unabhängig
davon, ob die Patienten die initiale Tripletherapie über 8 oder 12 Wochen
er-halten hatten. Im Gegensatz dazu
wurden bei Trägern des Nonresponder-Allels (rs12979860 CT oder TT) mit der
12-wöchigen Tripletherapie höhere SVR-Raten erzielt (71-73 %) als mit der
verkürzten Tripletherapie über 8 Wochen 15,16 (Abb. 4).
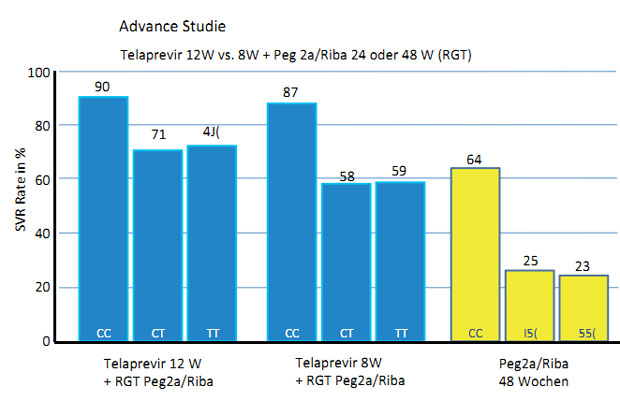
Abbildung 4: SVR-Raten in Abhängigkeit vom IL28B-Genotyp und der Dauer der Telaprevir-Tripletherapie (12 vs. 8 Wochen) im Vergleich zur dualen Therapie mit pegIFN plus Ribavirin – Ergebnisse der ADVANCE-Studie (nach 15).
Bedeutung der Zirrhose
Die Bedeutung der Therapiedauer für das Erreichen einer SVR bei unvorbehandelten Patienten mit Zirrhose konnte prospektiv im Rahmen der ILLUMINATE-Studie evaluiert werden (17 und Telaprevir-Fachinfo). Insgesamt hatten 61 Patienten bei Therapiebeginn eine Zirrhose und 30 der 61 Patienten erzielten eine eRVR. Die Heilungsraten lagen in der Gruppe der Zirrhose-Patienten mit eRVR bei 61 % 11/18, wenn die Therapie über insgesamt 24 Wochen (T12/PR24) und bei 92 % 11/12, wenn die Therapie über insgesamt 48 Wochen durchgeführt wurde (T12/PR48). Daher wird aktuell bei Patienten mit Zirrhose trotz Erreichen einer eRVR keine Verkürzung der Therapiedauer empfohlen. Da gerade Patienten mit Zirrhose die lang-fristige Interferon-Therapie schlecht vertragen, sind weitere Untersuchungen notwendig, um besser zwischen Zirrhose-Patienten mit guter und weniger guter Prognose zu differenzieren.
Bedeutung der minimalen HCV-Virämie
Die Persistenz einer minimalen HCV-Replikation unterhalb der Nachweisgrenze sensitiver HCV-RNA Tests ist Voraussetzung für das Auftreten eines Relapse. Mit Hilfe hochsensitiver HCV-RNA Tests (TMA) konnte in früheren Studien bei bis zu 30 % der Patienten unter einer dualen Therapie eine zum Teil langfristige Persistenz einer minimalen Virämie dokumentiert werden. Eine hohe initiale Viruslast und das Vorhandensein einer fortgeschrittenen Fibrose sind Faktoren, die mit der Persistenz einer minimalen Virämie und damit mit einem Relapse-risiko assoziiert sind. 18
Für die Response-gesteuerte Therapie ist jedoch die möglichst exakte Klassifizierung des ersten Zeitpunkts der HCV-RNA „Negativierung“ von zentraler Bedeutung. Mit keinem der bisher zu Verfügung stehenden HCV-RNA Tests kann jedoch eine minimale HCV-Replikation im Bereich von < 10 IU/ml sicher nachgeweisen. Bei einem Gesamtblutvolumen von ca. 5-6 Litern muss man selbst bei minimaler HCV-Replikation (< 5 IU/ml) von einer relevanten Blutviruslast in Höhe von ca. 15.000-18.000 Virionen ausgehen (5 IU/ml entsprechen etwa 3 Hepatitis C-Virionen pro Milliliter Blut).
Für die Phase-3-Studien mit Boceprevir und Telaprevir wurde zur Quantifizierung der HCV-RNA der Roche COBAS TaqMan® HCV 2.0 Test eingesetzt (16,17,19,20). Die untere Nachweisgrenze der HCV-RNA Quantifizierung (lower limit of quantification; LLOQ) in Plasma betrug 25 IU/ml und das Detektionslimit (limit of detection; LOD) 9.3-10 IU/ml. Daraus ergeben sich drei unterschiedliche HCV-RNA Responsekriterien:
- Quantifizierbare Virämie (≥ 25 IU/ml),
- detektierbare HCV-RNA aber unterhalb des LLOQ (Detectable/BLOQ; = Detected <25 IU/ml) und
- nicht nachweisbare Virämie (“not detected”) (Abb. 5).
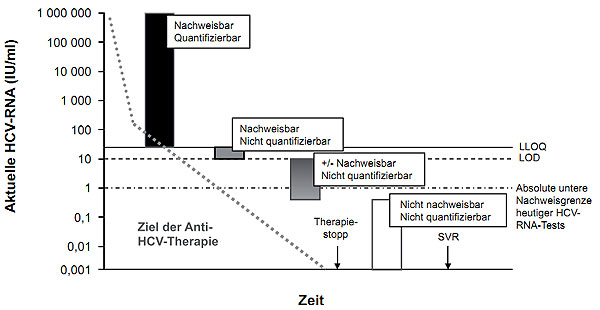
Abbildung 5: Zusammenfassung der unterschiedlichen qualitativen Level der HCV-RNA Konzentrationen unter einer antiviralen Therapie basierend auf der Hypothese optimal funktionierender HCV-RNA Tests. Nur wenn eine komplette Blockierung der Virusreplikation erreicht worden ist, kann eine „Heilung“ (SVR) der chronischen HCV Infektion erzielt und die Therapie beendet werden. Aktuelle HCV-RNA Tests sind nicht in der Lage, die HCV-RNA Konzentration < 1 IU/ml zu identifizieren (nach 21).
Für eine „Response-gesteuerte Therapieverkürzung“ haben sich nur Patienten mit anhaltender rascher und kompletter virologischer Response (eRVR) qualifiziert, d.h. wenn die HCV-RNA Konzentrationen zu Woche 4 der Tripletherapie nicht nachweisbar war („not detected“) und dies im weiteren Verlauf auch so blieb. Die Studien waren also nicht darauf ausgerichtet, die quantifizierbare Nachweisgrenze (LLOQ) als „cut-off“ für die Entscheidung zur Therapiever-kürzung zu untersuchen. Es besteht daher Unsicherheit, ob ein Befund „HCV-RNA nachweisbar aber nicht quantifizierbar“ („detectable/below limit of quantification“) einen klinisch relevanten Unterschied zum Befund „nicht nachweisbar“ im Hinblick auf die Möglichkeit zur Therapieverkürzung darstellt. Zur Frage der Frequenz und klinischen Relevanz von „detectable/below limit of quantification (BLOQ)“ HCV-RNA Testungen hat die Food and Drug Adminsitration (FDA) auf dem Boden der für die Boceprevir und Telaprevir Zulassung eingereichten Daten der Phase-2- und 3-Studien kürzlich umfangreiche Analysen vorgestellt 21:
- „Detectable/BLOQ“ kommt relativ häufig vor mit einem Häufigkeitsgipfel um die kritischen Zeitpunkte zur Steuerung der Therapiedauer.
- Patienten mit „Detectable/BLOQ“ HCV-RNA Tests unter Therapie hatten insgesamt niedrigere SVR-Raten im Vergleich zu solchen mit nicht nachweisbarer HCV-RNA zum selben Zeitpunkt.
- Die FDA empfiehlt daher, dass ein HCV-RNA Ergebnis „Detectable/BLOQ“ für die Entscheidung zur Response-gesteuerten Therapie nicht mit einem nichtnachweisbaren HCV- RNA Ergebnis gleichgesetzt werden sollte (Abb. 6-8).
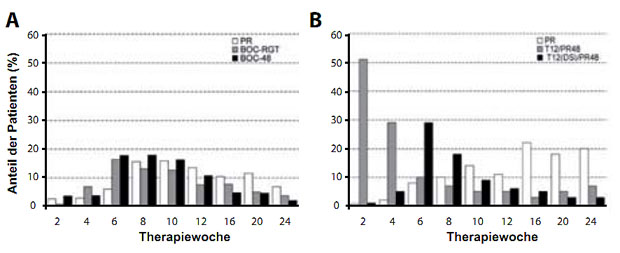
Abbildung 6: Prozentsatz der Patienten mit detektierbarer aber nicht quantifizierbarer HCV RNA (Detectable/BLOQ; = Detected <25 IU/ml) unter einer Tripletherapie mit Boceprevir (SPRINT-2-Studie) (A) oder Telaprevir (REALIZE-Studie) (B). DS = delayed start; ent-spricht dem Lead-in Arm in der REALIZE-Studie. PR = Peg-Interferon plus Ribavirin-Kontrollarm. (nach 21)
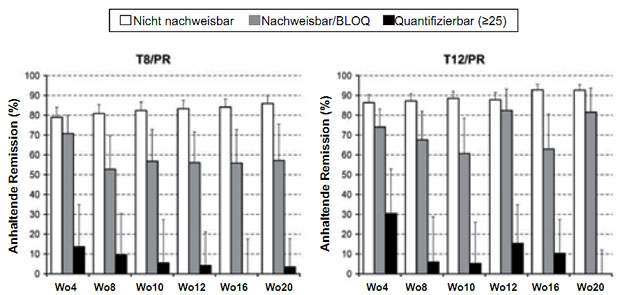
Abbildung 7: SVR-Raten in Abhängigkeit von den unterschiedlichen HCV-RNA Responsekategorien unter einer Telaprevir-Tripletherapie (Ergebnisse aus der ADVANCE-Studie bei unvorbehandelten Patienten mit HCV-Typ 1; T8/PR = 8 Wochen Tripletherapie plus 16 Wochen Peg-Interferon plus Ribavirin; T12/PR = 12 Wochen Tripletherapie plus 12 Wochen Peg-Interferon plus Ribavirin (nach 21).
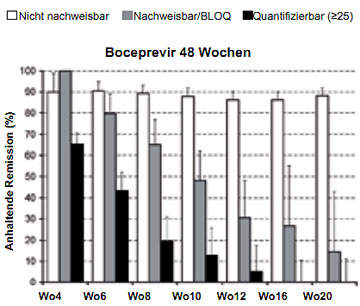
Abbildung 8: SVR-Raten in Abhängigkeit von den unterschiedlichen HCV-RNA Responsekategorien unter einer 48-wöchigen Boceprevir Tripletherapie (Ergebnisse aus der SPRINT-2-Studie bei unvorbehandelten Patienten mit HCV Typ 1) (nach 21).
Kriterien der Therapieverkürzung
Das im Rahmen der dualen Therapie entwickelte
Konzept der Therapieverkürzung bei HCV Typ 1-infizierten Patienten mit rascher
virologischer Response zu Behandlungswoche 4 hat sich auch für die Boceprevir-
und Telaprevir-basierte Tripletherapie etabliert. 22 Die Phase-3-Studie ILLUMINATE hat das Konzept der Response-gesteuerten
Therapie nochmals prospektiv bei 540 HCV Typ 1-infizierten Patienten
untersucht. 17
Alle Patienten mit eRVR nach 12-wöchiger Tripletherapie erhielten entweder eine
12- oder 36-wöchige Erhaltungstherapie mit Peg-IFNa-2a (180 µg) plus
Ribavirin (Gesamttherapiedauer 24 vs. 48 Wochen). Eine rasche virologische
Response wurde bei 72 % aller Patienten zur Woche 4 erreicht und das eRVR-Kriterium erfüllten
65 % zu Woche 12. Die Heilungsraten betrugen bei den eRVR-Patienten 92 % vs. 88 % nach einer
Gesamttherapiedauer von 24 vs. 48 Wochen. Die korrespondierenden Relapseraten
lagen bei 6 % vs. 2 %. Zusammenfassend unterstützen die Daten beider Studien das Konzept
einer „Response-gesteuerten“ Therapie mit Verkürzung der Therapiedauer auf 24
Wochen bei Patienten mit eRVR.
Zukunft: Weitere Verkürzung?
Heilungsraten von ca. 90 % nach 24-wöchiger
Therapiedauer mit einem Proteaseinhibitor in Kombination mit pegIFN und
Ribavirin bei Patienten mit eRVR legen die Vermutung nahe, dass eine weitere
Reduktion der Therapiedauer ohne Verlust an Effektivität, bei einer be-stimmten
Patienten-Subgruppe möglich sein könnte. Eine alleinige 12-wöchige Telaprevir-basierte
Tripletherapie wurde bereits im Rahmen einer Phase-2-Studie in Europa
evaluiert. 23 Im Vergleich zur
24-wöchigen Therapiedauer betrugen die SVR-Raten bei 12-wöchger Therapie 62 % vs. 68 %. Die
Relapseraten waren
jedoch bei 12-wöchiger Therapie mit insgesamt 30 % signifikant höher
als bei 24-wöchiger Therapiedauer (14 %). Betrachtete man jedoch nur die
Patienten mit RVR, so waren die Relapseraten nicht mehr deutlich
unterschiedlich (22 % vs. 11 % bei 12- und 24-wöchiger Therapiedauer). Erste retrospektive Analysen
zum Einfluss des IL28B-Genotyps sprechen dafür, dass nahezu alle Patienten mit
IL28B CC-Genotyp mit einer 12-wöchigen Therapie geheilt werden konnten.
Aktuelle Studien evaluieren prospektiv die Effektivität einer 12-wöchigen
Therapiedauer bei Patienten mit günstigem IL28B-Genotyp.
Therapiedauer nach kompletter virologischer Response
Ein bisher ungelöstes Problem ist die Dauer der Erhaltungstherapie nach Induktion einer kompletten virologischen Response festzulegen, die nötig ist, um einen den Relapse zu verhindern. Die fehlende Möglichkeit mittels Serum HCV-RNA Bestimmungen eine „Null-Virämie“, das bedeutet die komplette Blockierung der HCV RNA Replikation nachzuweisen, ermöglicht uns nur anhand der viralen Kinetik sowie bestimmter „Baselinefaktoren“ (wie Ausgangsviruslast, Fibrosestadium, LDL-, GGT-Konzentration und IL28B Genotyp) eine grobe Abschätzung des Relapserisikos und damit der notwendigen Therapiedauer.
Wir sind bisher, anhand unserer Erfahrungen
mit der dualen Therapie, davon ausgegangen, dass je länger es dauert bis zur
virologischen Response umso länger auch die Erhaltungstherapie durchgeführt werden muss (also Woche 4 Response – 20 Wochen Erhaltungstherapie; Woche 12 Response – 36 Wochen
Erhaltungstherapie und Woche 24 Response – 48 Wochen Erhaltungstherapie, Abb.
1). Beim Einsatz direkt antiviraler wirksamer Substanzen hat sich jedoch
gezeigt, dass manche Patienten auch bei sehr kurzer Therapiedauer (z.B. 2-4
Wochen) geheilt werden konnten. Offenbar kann HCV nach kompletter Blockierung
der HCV-Replikation nur für wenige Tage (Wochen?) im Körper persistieren. Aus
diesen Überlegungen würde sich ein anderes Konzept zur Dauer der
Erhaltungstherapie ergeben, die notwendig ist, um den Relapse zu verhindern
(Abb. 9): Unabhängig vom Zeitpunkt unter Therapie ist nach Erreichen einer
tatsächlich kompletten virologischen Response mit Blockierung der HCV RNA
Replikation immer nur eine kurze und fixe Erhaltungstherapiedauer notwendig, um
die HCV-Infektion zu eradizieren.
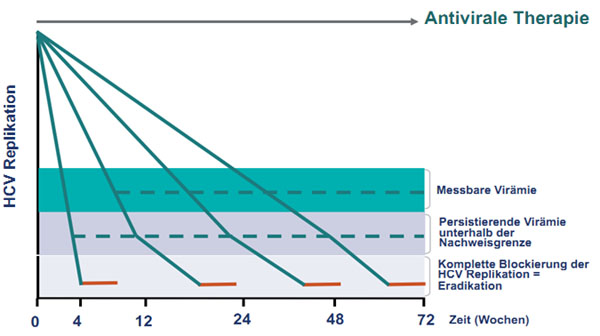
Abbildung 9: Neues Konzept der Response-gesteuerten Therapie: Bei Erreichen einer kom-pletten virologischen Response (Blockierung der HCV-RNA Replikation) ist unabhängig vom Zeitpunkt (Therapiewoche) immer nur eine kurze und fixe Erhaltungstherapiedauer notwendig (rote Linie), um die HCV-Infektion zu eradizieren.
Literatur
Sarrazin C, Berg T, Ross RS, Schirmacher P, Wedemeyer H, Neumann U,
Schmidt HH, et al. [Prophylaxis,
diagnosis and therapy of hepatitis C virus (HCV) infection: the German
guide-lines on the management of HCV infection]. Z Gastroenterol 2011;
48:289-351.
Berg T. Tailored treatment for hepatitis C. Clin Liver Dis 2008;12:507-528
Berg T, von Wagner M, Nasser S, Sarrazin C, Heintges T, Gerlach T, Buggisch P, Goeser T, Rasenack J, Pape GR, Schmidt WE, Kallinowski B, Klinker H, Spengler U, Martus P, Alshuth U, Zeuzem S. Extended treatment duration for hepatitis C virus type 1: comparing 48 versus 72 weeks of peginterferon alpha-2a plus ribavirin. Gastroenterology 2006, 130: 1086-1097
Berg T, Weich V, Teuber G, Klinker H, Möller B, Rasenack J, Hinrichsen H, Gerlach T, Spengler U, Buggisch P, Balk H, Zankel M, Neumann K, Sarrazin C, Zeuzem S. Individualized treatment strategy according to early viral kinetics in hepatitis C virus type 1-Infcted patients. Hepatology 2009, 50: 369-77
Sarrazin C, Schwendy S, Möller B, Dikopoulos N, Buggisch P, Encke J, Teuber G, Goeser T, Thimme R, Klinker H, Boecher W, Schulte-Frohlinde E, Prinzing R, Herrmann E, Zeuzem S and Berg T. Improved responses to pegylated interferon alfa-2011;epub.
Weich V, Herrmann E, Chung TL, Sarrazin C, Hinrichsen H, Buggisch P, Gerlach T, Klinker H, Spengler U, Bergk A, Zeuzem S, Berg T: The Determination of GGT is the most reliable predictor for responsiveness to interferon-alpha based therapy in HCV type 1-infection, J Gastroenterol 2011, Sep 13. [Epub ahead of print]
Berg T, Andreone P, Pol S, et al. Predictors of virological response with telaprevir-based combination treatment in HCV genotype 1-infected patients with prior peginterferon/ribavirin treatment failure: Post-hoc analysis of the phase III realize study. Hepatology 2011; 54 (4, Suppl): 375A.
Sulkowski MS, Asselah T, Ferenci P, et al. Treatment with the second generation HCV pro-tease inhibitor BI201335 results in high and consistent SVR rates – results from SILEN-C1 in treatment-naïve patients across different baseline factors. Hepatology 2011;54(4, Suppl):473A.
Li JH, Qian Lao X, Tillmann HL, Rowell J, Patel K, Thompson A, Suchindran S, et al. Inter-feron-lambda genotype and low serum low-density lipoprotein cholesterol levels in patients with chronic hepatitis C infection. Hepatology 2010; 51:1904-11.
Thompson AJ, Muir AJ, Sulkowski MS, Ge D, Fellay J, Shianna KV, Urban T, et al. IL28B polymorphism Improves Viral Kinetics and Is the Strongest Pre-treatment Predictor of SVR in HCV-1 Patients. Gastroenterology 2010; 139: 120-9.
Thompson AJ, Clark PJ, Tillmann HL, et al. IL28B C/C genotype is predictive of ≥ 1 log 10 IU/mL reduction in plasma HCV RNA after 4 weeks of peginterferon (pegIFN) and ribavirin (RBV) therapy: Implications for the use of the lead-in strategy for direct-acting antiviral-based treatment regimens. Hepatology 2011; 54 (4, Suppl): 436A.
Ge D, Fellay J, Thompson AJ, Simon JS, Shianna KV, Urban TJ, Heinzen EL, Qiu P, Bertel-sen AH, Muir AJ, Sulkowski M, McHutchison JG and Goldstein DB. Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance. Nature 2009;461:399-401.
Suppiah V, Moldovan M, Ahlenstiel G, Berg T, Weltman M, Abate ML, Bassendine M, Spengler U, Dore GJ, Powell E, Riordan S, Sheridan D, Smedile A, Fragomeli V, Muller T, Bahlo M, Stewart GJ, Booth DR and George J. IL28B is associated with response to chronic hepatitis C interferon-alpha and ribavirin therapy. Nat Genet 2009;41:1100-1104.
Tanaka Y, Nishida N, Sugiyama M, Kurosaki M, Matsuura K, Sakamoto N, Nakagawa M, Korenaga M, Hino K, Hige S, Ito Y, Mita E, Tanaka E, Mochida S, Murawaki Y, Honda M, Sakai A, Hiasa Y, Nishiguchi S, Koike A, Sakaida I, Imamura M, Ito K, Yano K, Masaki N, Sugauchi F, Izumi N, Tokunaga K and Mizokami M. Genome-wide association of IL28B with response to pegylated interferon-alpha and ribavirin therapy for chronic hepatitis C. Nat Genet 2009;41:1105-1109.
Jacobsen IM, Catlett I, Marcellin P, et al. Telaprevir substantially improved SVR rates across all IL28B genotypes in the ADVANCE trial. J Hepatol 2011; 54; (Suppl.1): S524
Jacobson IM, McHutchison JG, Dusheiko G, Dibisceglie AM, Reddy KR, Bzowej N, Marcellin P, Muir AJ, Ferenci P, Flisiak R, George J, Rizzetto M, Shouval D, Sola R, Terg R, Yoshida EM, Adda N, Bengtsson L, Sankoh AJ, Kieffer TL, George S, Kauffman RS and Zeuzem S. Telaprevir for previously untreated chronic hepatitis C virus infection. New Eng-land Journal of Medicine 2011;364:2405-2416.
Response-Guided Telaprevir Combination Treatment for Hepatitis C Virus Infection, Kenneth E. Sherman, M.D., Ph.D., Steven L. Flamm, M.D., Nezam H. Afdhal, M.D., David R. Nelson, M.D., Mark S. Sulkowski, M.D., Gregory T. Everson, M.D., Michael W. Fried, M.D., Michael Adler, M.D., Ph.D., Hendrik W. Reesink, M.D., Ph.D., Marie Martin, Ph.D., Abdul J. Sankoh, Ph.D., Nathalie Adda, M.D., Robert S. Kauffman, M.D., Ph.D., Shelley George, M.D., Christopher I. Wright, M.D., Ph.D., and Fred Poordad, M.D. for the ILLUMINATE Study Team, N Engl J Med 2011; 365:1014-1024;
Wiegand J, Neumann K, Böhm S, Weich V, Teuber G, Klinker H, Möller B, Rasenack J, Hin-richsen H, Gerlach T, Spengler U, Buggisch P, Sarrazin C, Berg T. Importance of minimal residual viremia for relapse prediction in patients with chronic hepatitis C genotype 1 infec-tion. Clin Infect Dis. 2011 Dec;53(11):1111-4. Epub 2011 Oct 21
Poordad F, McCone J, Jr., Bacon BR, Bruno S, Manns MP, Sulkowski MS, Jacobson IM, Reddy KR, Goodman ZD, Boparai N, DiNubile MJ, Sniukiene V, Brass CA, Albrecht JK and Bronowicki JP. Boceprevir for untreated chronic HCV genotype 1 infection. N Engl J Med 2011;364:1195-1206.
Zeuzem S, Andreone P, Pol S, Lawitz E, Diago M, Roberts S, Focaccia R, Younossi Z, Foster GR, Horban A, Ferenci P, Nevens F, Müllhaupt B, Pockros P, Terg R, Shouval D, van Hoek B, Weiland O, van Heeswijk R, De Meyer S, Luo D, Boogaerts G, Polo R, Picchio G and Beumont M. Telaprevir for retreatment of HCV infection. New England Journal of Medicine 2011;364:2417-2428.
Harrington PR, Zeng W, Naeger LK. Clinical relevance of detectable but not quantifiable hepatitis C virus RNA during boceprevir or telaprevir treatment. Hepatology 2011, epub
Sarrazin C, Berg T, Cornberg M, et al. Expertenempfehlungen zur Triple-Therapie der HCV Infektion mit Boceprevir und Telaprevir. Z Gastroenterol 2012, im Druck
Hezode C, Forestier N, Dusheiko G, Ferenci P, Pol S, Goeser T, Bronowicki JP, Bourliere M, Gharakhanian S, Bengtsson L, McNair L, George S, Kieffer T, Kwong A, Kauffman RS, Alam J, Pawlotsky JM and Zeuzem S. Telaprevir and peginterferon with or without ribavirin for chronic HCV infection. N Engl J Med 2009;360:1839-1850.





