Wolfram H. Gerlich
und Dieter Glebe, Gießen
Hepatitis
B-Impfung: altbewährt, doch nicht perfekt
So ist die Zahl der nicht geschützten „Non-Responder“ größer als die frühen Feldversuche erwarten ließen. Die seit 20 Jahren bekannten impfungsresistenten Escape-Mutanten sind möglicherweise doch ein größeres Problem als bislang vermutet. Sie treten gehäuft bei okkulten HBV-Infektionen auf, die ihrerseits viel häufiger sind als allgemein angenommen wurde. Klinisch sind diese schwach aktiven Infektionen mutmaßlich unbedeutsam solange das Immunsystem sie unter Kontrolle hält. Bei Immundefizienz können sich die okkulten Escape-Varianten jedoch zu sehr großen Zahlen vermehren und im schlimmsten Fall tödliches Leberversagen hervorrufen. Diese klinisch äußerst bedeutsame Reaktivierung könnte besonders in Afrika ein großes Problem werden, weil dort zu einer bereits in der Kindheit erworbenen okkulten HBV-Infektion im Erwachsenenalter oft eine HIV-Infektion hinzukommt. Auch die verschiedenen Genotypen des Hepatitis B Virus verdienen mehr Beachtung, da der verfügbare Impfstoff mit dem weltweit eher seltenen Genotyp A2 gegen die meisten anderen Genotypen nicht so gut schützt. Klinisch stumme HBsAg-negative HBV-Infektionen bei niedrigem Antikörperspiegel sind seit langem bekannt, wurden aber bislang für unbedeutsam gehalten. Gerade diese Impfdurchbrüche führen aber, paradoxerweise, dazu, dass die Impfung die Sicherheit von Bluttransfusionen hinsichtlich Hepatitis B nicht erhöht, sondern verringert.
Hepatitis B – die Krankheit
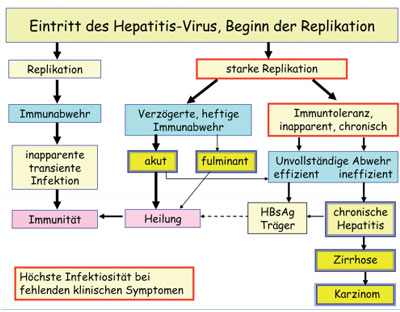
Abb. 1: Verlaufsformen der Hepatitis B-Virus-Infektion je nach Zeitpunkt und Stärke der Immunantwort
Die Infektion mit Hepatitis B Virus (HBV) kann einen sehr unterschiedlichen Verlauf nehmen (Abb. 1). HBV vermehrt sich fast ausschließlich in Leberzellen und kann diese nur auf dem Blutweg erreichen. Da es sich nur sehr langsam vermehrt, kann im günstigen Fall die Infektion vom Immunsystem unter Kontrolle gebracht werden, bevor viele Leberzellen befallen wurden. Auf diese Weise kann unbemerkt eine Immunität gegen HBV erworben werden (Abb. 1). Wegen der besonderen tolerogenen Funktionen der Leber kommt es aber oft zum verzögerten Einsetzen des Immunsystems und somit im Verlauf von Monaten zur Infektion fast aller Leberzellen sowie zu einer riesigen Viruslast im Blut (Abb. 1).
Das Virus selbst ist nicht pathogen. Das Immunsystem kann aber das Virus langfristig nur durch Blockade oder gar Zerstörung der infizierten Zellen unter Kontrolle bringen (Immunpathogenese), was sich als akute Hepatitis mit schweren Funktionsausfällen der Leber bemerkbar macht. Bei immunologisch unreifen (Neugeborenen, Kleinkindern) oder geschwächten Personen, aber auch bei einem Teil (ca. 5%) anscheinend immunkompetenter Personen kommt es zu einer langdauernden Immuntoleranz gegen HBV, so dass dieser Personenkreis ohne wesentliche Krankheitssymptome große Mengen Virus in Leber und Blut enthält und eine unerkannte langfristige Infektionsquelle darstellt (Abb.1 rechts). Schließlich kommt es bei diesen Virusträgern nach Jahren oder Jahrzehnten doch zu einer mehr oder weniger effizienten Immunabwehr, was im günstigen Fall in einem immunkontrollierten wenig infektiösen HBsAg-Träger-Status, im ungünstigen Fall in einer chronischen Hepatitis resultiert. Auch die chronische Hepatitis B beginnt wegen der zunächst milden Symptome meist unbemerkt. Langfristig führt sie jedoch bei etwa 20% der Patienten nach Jahrzehnten unbehandelt zum weitgehenden Umbau des Lebergewebes in nicht funktionelles Narbengewebe (Leberzirrhose) und damit in der Endphase zu komplettem Leberversagen. Eine weitere häufige Spätfolge ist Leberkrebs, für den HBV weltweit gesehen die Hauptursache ist. Weltweit sind 370 Millionen Menschen chronisch mit diesem tückischen Virus infiziert, eine Million verstirbt jährlich an den Spätfolgen.
Impfstoffentwicklung gegen HBV
Entdeckung des Erregers
Die epidemische Gelbsucht war schon in der Antike bekannt, jedoch führte man die Krankheit auf schlechte Lebensumstände und nicht auf eine Infektion zurück. Die infektiöse Natur der Erkrankung erkannte Lürmann 1885, als nach einer Impfaktion gegen Pocken in Bremen gehäuft Fälle von Gelbsucht auftraten. Dem Impfstoff wurde damals zur Stabilisierung menschliche „Lymphe“ zugesetzt. Auch später gab es weltweit zahlreiche Ereignisse, bei denen Hepatitis-Erreger durch invasive medizinische Eingriffe (z.B. Impfungen mit mehrfach verwendeten Spritzen) massenhaft übertragen wurde. Auf der Basis epidemiologischer Beobachtungen wurden zwei Formen von Hepatitis Erregern postuliert: Typ A wird vorwiegend fäkal-oral über verschmutztes Trinkwasser oder Lebensmittel, Typ B dagegen vorwiegend parenteral, z.B. über Blut oder Blutprodukte übertragen. Die Entdeckung des Erregers der Typ B Hepatitis (HBV) begann 1963 als der Arzt und Anthropologe Baruch S. Blumberg vom Institute for Cancer Research in Philadelphia (Nobelpreis 1976) mit relativ simplen immunologischen Methoden nach genetischen Unterscheidungsmerkmalen in menschlichen Seren suchte. Im Blut von australischen Ureinwohnern fand sein Mitarbeiter Harvey Alter ein neues Antigen, welches daher „Australia-Antigen“ genannt wurde. Die Natur dieses Antigens blieb jedoch zunächst rätselhaft. Unabhängig davon suchte Alfred Prince vom New York Blood Center nach Antigenen bei Hepatitis-Patienten und entdeckte 1968 ein „Serum-Hepatitis-Antigen“, welches sich jedoch bald darauf als identisch mit dem Australia-Antigen erwies (Abb. 2). Auch Blumberg hatte mittlerweile das gehäufte Vorkommen dieses Antigens bei Hepatitis-B-Patienten erkannt. Blumberg, Prince und eine Reihe anderer Forscher (darunter auch Gerlich) konnten in der Folgezeit Australia-Antigen auf 20 Nanometer (nm = 10-9 m) großen, entfernt virus-ähnlichen Partikeln nachweisen (Abb. 2 rechts). Gegen deren Virusnatur sprach aber das Fehlen von Nukleinsäure, worauf Blumberg postulierte, dass es sich um einen Scrapie-ähnlichen, Nukleinsäure-freien infektiösen Erreger handeln würde. (Dies war damals eine kühne Hypothese, die sich aber nur für Scrapie als richtig erwies. Auch der sog. Rinderwahnsinn wird von einem derartigen Erreger hervorgerufen). Der Londoner Virologe David Dane entdeckte zwei Jahre später im Elektronenmikroskop neben den sehr zahlreichen 20 nm großen Teilchen auch 45 nm große virusartige Teilchen, die auf ihren Hüllproteinen das Australia-Antigen trugen und heute als HBV bekannt sind (Abb. 3). 1973 gelang es dem amerikanischen Virologen William S. Robinson innerhalb der „Dane-Partikel“ zunächst die virale DNA-Polymerase und bald danach auch die Virus-DNA nachzuweisen und damit den Weg für deren molekularbiologische Untersuchung zu eröffnen.

Abb. 2: Die Entdecker des Australia-Antigens (B. B., H. A.), bzw. des Serum-Hepatitis-Antigens (A. P.). Aus Australia bzw. Serum-Hepatitis-Antigen positiven Seren konnten 20 nm große Partikel (rechts) isoliert werden, die man kurze Zeit für den Erreger der Hepatitis B hielt.
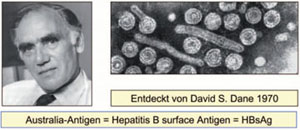
Abb. 3: David Dane und die von ihm im Blut von Hepatitis-Patienten entdeckten, 42-45 nm großen, doppelschaligen Viruspartikel mit Australia-Antigen auf der Oberfläche.
Impfstoff
der 1. Generation. Schon 1969 vermutete Blumberg, dass
das in großen Mengen im Blut von Hepatitis-Patienten zirkulierende
Australia-Antigen einen schützenden Impfstoff darstellen könnte und meldete
dies als Patent an. Der Kinderarzt Saul Krugman testete 1970 in den USA
Hitze-behandeltes Australia-Antigen-haltiges Serum als möglichen Impfstoff an
29 geistig behinderten Kindern, indem er diese nach der Impfung, in ethisch
abzulehnender Weise, gezielt mit HBV infizierte und dabei eine Schutzrate von
rund 60% beobachtete. John Gerin und Robert Purcell zeigten in einem wissenschaftlich
überzeugenderen und ethisch vertretbaren Infektionsversuch an Schimpansen, den
einzigen geeigneten Versuchstieren, dass gereinigtes und virus-inaktiviertes
Australia-Antigen aus dem Plasma von HBV-Trägern einen wirksamen HBV-Impfstoff
darstellt. Im Jahr 1980 wies Wolf Szmuness in einer Placebo-kontrollierten
Feldstudie unter 1000 männlichen Homosexuellen in New York (einer klassischen
Risikogruppe für Hepatitis B) die hohe Schutzwirkung eines ähnlichen, von der
Fa. Merck Sharp and Dome (MSD) hergestellten Impfstoffs in der Praxis nach. Es
folgte eine weltweite Impfempfehlung der Weltgesundheitsorganisation (WHO) für
HBV-Risikogruppen und Neugeborene in HBV-Hochendemiegebieten.
2.
Generation. Obwohl die HBV-Impfstoffe der ersten
Generation aus dem Plasma HBV-infizierter Spender sicher und sehr wirksam
waren, begann man mit dem Aufkommen der Gentechnik in den 1980er Jahren,
HBV-Impfstoffe in genetisch veränderten Wirtszellen herzustellen und sich so
von dem hoch-infektiösen und nur begrenzt verfügbaren HBV-Träger-Plasma
unabhängig zu machen. Durch die 1978 gelungene Klonierung und Sequenzierung des
HBV-Genoms in den Arbeitsgruppen von Pierre Tiollais, Kendrick Murray und
William Rutter wurde das Virus einer
molekularbiologischen Analyse zugänglich. Nach heute
üblicher Nomenklatur wird Australia-Antigen als Hepatitis B Virus
surface-Antigen (HBsAg) bezeichnet. Es besteht aus einem Protein mit 24.000
Dalton Molgewicht, welches sich spontan innerhalb der Zelle zu den bekannten 20
nm großen runden Teilchen zusammenlagert (Abb. 2; HBsAg). 1982 gelang es Pablo
Valenzuela für MSD und Michel de Wilde für den Impfstoff-Hersteller Rixensart
in Belgien (heute GSK), HBsAg durch Rekombination des Gens für dieses Protein
mit einem genetischen Expressionsvektor in Hefezellen (Saccharomyces
cerevisiae) herzustellen. Im Schimpansen-Versuch bewirkte dieses „rekombinante“
HBsAg als Impfstoff einen zuverlässigen Schutz gegen eine HBV Infektion und
seitdem wird es mit großem Erfolg eingesetzt. Das rekombinante HBsAg ist der erste
amtlich zugelassene, gentechnisch hergestellte Impfstoff mit weltweiter
Anwendung. Bedenkt man, dass eine chronische HBV-Infektion oft zu Leberkrebs
führt, ist dies zugleich auch der erste Impfstoff gegen eine bestimmte
Krebsform.
Im Jahr 1992 beschloss die WHO, HBV durch ein weltweites Impfprogramm für die gesamte Bevölkerung schrittweise auszurotten. Mehr als 171 Länder, darunter auch Deutschland, haben die Impfung gegen HBV in ihre nationalen Impfempfehlungen aufgenommen. Der Impfstoff wird intramuskulär verabreicht und enthält die vielfach erprobten Adjuvantien (Wirkverstärker) Aluminium-Hydroxid oder -Phosphat. Der beste Kompromiss aus Schutzwirkung und Aufwand wird mit drei Dosen im Abstand von 0, einem und 6 Monaten erzielt. Über 2 Milliarden Dosen wurden bislang weltweit verabreicht, ohne dass es nachweislich zu ernsten Nebenwirkungen kam. Entgegen vereinzelten kritischen Berichten sind die momentan verfügbaren Impfstoffe aus gentechnischer Herstellung nach heutigem Kenntnisstand sicher. Bei einem kleinen Teil der Geimpften wurden lokale und leichte allgemeine Nebenwirkungen im Sinne einer normalen Entzündungsreaktion beobachtet.
Schutzwirkung des Impfstoffs
HBsAg ist wie die meisten viralen Hüllantigene kein besonders gutes Immunogen. So ist die erforderliche Impfdosis mit 10 bzw. 20 Mikrogramm rund tausendmal höher als bei dem Hepatitis-A-Impfstoff, der aus abgetöteten, nicht behüllten Viren besteht und man benötigt eine Dosis mehr. Die Schutzwirkung des HBV-Impfstoffes der zweiten Generation ist dennoch bei Kindern und jungen gesunden Erwachsenen sehr gut. In Deutschland hat die Zahl der jährlich gemeldeten akuten Hepatitis B Fälle seit Einführung der allgemeinen HB-Impfung von 6.135 im Jahr 1997 auf etwa 748 in 2009 abgenommen, was zu einem guten Teil auch auf die Impfung zurückzuführen sein wird. An der Zahl der chronisch infizierten HBV-Träger kann die Impfung naturgemäß so schnell nichts ändern, sodass die Infektionsgefahr für nicht immune Personen zunächst weiterbesteht.
Für den Schutz entscheidend ist, dass in den Wochen nach der dritten Dosis ein ausreichender Antikörperspiegel gegen das HBsAg (Anti-HBs) erreicht wird. In den frühen Impfstudien, die häufig an jungen weiblichen Personen durchgeführt wurden, war dies zu fast 100% der Fall. Nun ist diese Personengruppe junger Frauen auf Grund humanbiologischer Gegebenheiten prädestiniert, besonders wirksam Antikörper zu produzieren, um ihre Neugeborenen durch die passiv übertragenen Antikörper vor Infektionen zu schützen. Die langjährige Erfahrung in der Praxis zeigt, dass nicht wenige Geimpfte keine oder sehr wenig Antikörper bilden (Non- oder Low-Responder) und dann auch nicht geschützt sind. Neben vermeidbaren Faktoren, wie Übergewicht oder Rauchen, die zum Impfversagen führen, gibt es auch unbeeinflussbare Faktoren, wie männliches Geschlecht, fortgeschrittenes Alter und genetische Veranlagung, sodass bei Zusammenkommen mehrerer negativer Faktoren bis zu 40% Non-Responder auch unter anscheinend gesunden Menschen auftreten können. Ein weiterer Nachteil des Impfstoffs ist, dass schon eine moderate Schwächung des Immunsystems die Schutzwirkung erheblich vermindert und dann, z.B. bei HIV-Infizierten (auch mit noch normaler CD4+-Zellzahl) und bei Dialysepatienten, sehr viele Non-Responder gefunden werden.
Seit langem weiß man, dass der Anti-HBs-Spiegel nach der 3. Impfung zunächst hoch ist, dann aber recht rasch abfällt und nach Jahren u. U. ganz verschwindet. Bei stark abgefallener oder gar nicht mehr nachweisbarer Antikörpermenge nach Impfung kann es bei Exposition mit HBV zu sogenannten „okkulten“ Infektionen kommen, die sehr schwer diagnostizierbar sind, da nur eine sehr geringe Viruslast im Blut vorkommt und das HBsAg meist gar nicht nachweisbar ist. Erst nachträglich findet man bei diesen Personen oftmals Antikörper gegen das Core-Antigen des HBV (Anti-HBc) was auf die stattgefundene Infektion hinweist. An sich sind diese Infektionen für den Betroffenen harmlos, weil durch die Impfung ein immunologisches Gedächtnis erzeugt wurde, welches die HBV-Infektion auf niedrigem Niveau hält, sodass keinerlei Krankheitssymptome feststellbar sind. Ein Problem sind diese okkulten Infektionen jedoch bei Bluttransfusionen, da die geimpften, aber infizierten Spender nach neuesten Befunden der Blutspendedienste des Amerikanischen Roten Kreuzes über mehrere Wochen oder sogar Monate das infektiöse HBV im Blut tragen und so den Blutempfänger infizieren könnten, ohne dass bei diesen Spendern der üblicherweise bestimmte HBV-Marker HBsAg nachweisbar wäre (Stramer et al., 2010). Insgesamt gab es bei dieser Studie an 3,7 Millionen Blutspenden nur 9 Spender, die HBV-DNA positiv aber HBsAg und Anti-HBc negativ waren und somit als frisch okkult infiziert galten. Sechs davon waren geimpft (Tab. 1), was bedeutet, dass eine länger zurückliegende Impfung das Auftreten der schwer nachzuweisenden okkulten Infektionen begünstigt während bei nicht geimpften Personen das HBsAg fast immer nachweisbar war, wenngleich etwas später als die HBV-DNA. Da Spender mit frischer okkulter HBV-Infektion nur durch den hochempfindlichen Nachweis von HBV-DNA erkannt werden können, wird dieser Test jetzt wohl routinemäßig in den USA eingeführt und zwar in Kombination mit der bereits durchgeführten Testung auf HIV- und HCV-RNA. In Deutschland praktizieren die Blutspendendienste des Roten Kreuzes seit langem diese zusätzliche Testung auf HBV DNA, jedoch ist sie nicht bindend vorgeschrieben. Aus Kostengründen werden zumeist nur Minipools von mehreren (bis zu 96) Spenden getestet und bei positivem Befund wird die einzelne Spende durch Nachtestung identifiziert. Während dieses Vorgehen für HIV und HCV wegen der rasch ansteigenden Virämie nur ganz selten zu falsch negativen Ergebnissen führt, wird bei HBV wegen des sehr langsamen Anstiegs der Virämie je nach Testempfindlichkeit ein wesentlicher Teil der frisch infizierten Spender nicht erkannt werden.
Genetische Variabilität des HBV
Die genetische Variabilität hat bislang die Entwicklung von wirksamen Impfstoffen gegen HIV oder Hepatitis C Virus verhindert. Bei HBV glaubte man bis vor kurzem, dass die Variabilität kein wesentliches Problem darstellt, da bei den frühen Schutzversuchen der Impfstoff auch gegen Infektion mit HBV eines anderen Genotyps schützte und Escape-Mutanten nur selten beobachtet wurden. Dies könnte sich aber in Zukunft ändern.
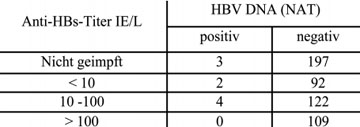
Tab. 1: Anti-HBs Titer bzw. Impfstatus in 9 nur HBV DNA (NAT) positiven
und in 520 negativen Kontrollspendern des Amerikanischen Roten Kreuzes
ohne HBsAg und Anti-HBc.
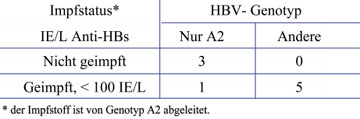
Tab. 2: HBV-Genotypen in ungeimpften und geimpften*, aber nicht
vollständig geschützten okkult mit HBV infizierten US-Blutspendern
Genotypen. HBV kommt in mindestens neun Genotypen vor, die mit den Buchstaben A – I bezeichnet werden. Darüber hinaus gibt es Subgenotypen, z.B. A1-7. In Mitteleuropa und den USA herrscht A2 vor. Die Ergebnisse aus den geimpften US-Blutspendern lassen vermuten, dass der übliche Impfstoff, der vom Subgenotyp A2 abgeleitet ist, besser gegen das HBV des gleichen Subgenotyps schützt als gegen die anderen (Sub-) Genotypen. Nur einer der sechs identifizierten okkult infizierten Spender mit früherer HB-Impfung hatte A2, während unter den HBV-Trägern in den USA zu 80% der Subgenotyp A2 vorherrscht (Tab. 2). Die Daten legen außerdem nahe, dass (wie bislang schon vermutet) 10 Internationale Einheiten pro Liter Serum (IE/L) des durch den Impfstoff hervorgerufenen Anti-HBs-Antikörpers vollständig, also auch vor einer okkulten Infektion, mit HBV/A2 schützen. Bei Exposition, z.B. durch sexuellen Kontakt mit einem HBV-Träger mit anderen HBV-Genotypen wird dagegen eine okkulte Infektion begünstigt, sobald der Anti-HBs-Spiegel unter 100 IE/L liegt. Leider haben nur 30% der geimpften US Blutspender >100 IE/L (Tab. 1), was für das Blutspendewesen neue, unerwartete Probleme aufwirft (Stramer et al., 2010). Weltweit hat nur 1% der 370 Millionen HBV-Träger Subgenotyp A2, die meisten haben Genotyp B, C und D. Es läge daher nahe zu prüfen, ob mit Impfstoffen, die von den häufigeren Genotypen abgeleitet sind, ein besserer Schutz erzielbar ist.
Escape-Mutanten nach Impfung. Ein weiteres Problem ist das Auftreten von Escape-Mutationen. Die erste Mutation dieser Art, die 1990 von William Carman bei geimpften, Anti-HBs-positiven Kleinkindern HBV-infizierter Mütter gefunden wurde, war der Austausch der Aminosäure Glycin in Position 145 des SHBs-Proteins gegen Arginin (kurz: G145R). Durch die Mutation konnte der vom Impfstoff induzierte Antikörper nicht mehr an das mutierte Virus binden, sodass die Mutante sich ungehemmt vermehren konnte. Folgeuntersuchungen an geimpften Schimpansen legten nahe, dass diese Mutante kein Problem darstellt, wenn die Infektion erst nach erfolgreicher Impfung stattfindet. Bei der oben erwähnten Studie an US-Blutspendern wurde jedoch auch ein Fall beobachtet, wo selektiv die G145R-Mutante, und nicht die bei dem infizierten Sexualpartner vorherrschende Normvariante des Genotyps C auf den geimpften Spender übertragen wurde. Inzwischen sind viele weitere Escape-Mutanten des HBsAg beschrieben worden (s.u.) und zwar nicht nur bei Probanden, die mutmaßlich bereits vor Impfung infiziert waren.
Einfluss
der HBV-Therapie. HBsAg-Mutanten entstehen gehäuft bei
Patienten mit chronischer Hepatitis B, die mit Inhibitoren der reversen
Transkriptase des HBV therapiert werden. HBV zeigt auf Grund seines extrem
kleinen Genoms die Besonderheit, dass der Genom-Abschnitt, der die reverse
Transkriptase kodiert, gleichzeitig auch das HBsAg kodiert. Unglücklicherweise
werden während der Therapie oft resistente Mutanten gegen das Medikament
selektiert, die nicht nur zum Versagen der Therapie führen, sondern auch
Mutationen im HBsAg aufweisen. Experimentell wurde kürzlich gezeigt, dass
erfolgreich mit dem üblichen Impfstoff geimpfte Schimpansen nicht sicher vor
einer Infektion mit diesen speziellen Virus-Varianten geschützt waren. Diese
Mutanten sind gut vermehrungsfähig und könnten sich daher auch in einer
Population mit hohem Impfschutz, wie z.B. in Deutschland, verbreiten.
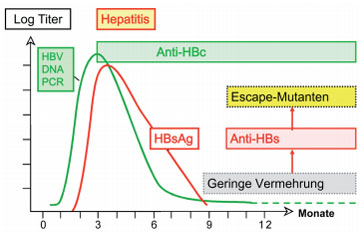
Abb. 4: Entstehung von Escape-Mutanten nach Überstehen einer apparenten akuten HBV-Infektion
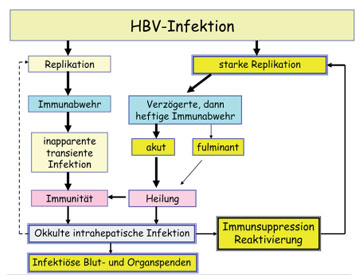
Abb. 5: Entstehung und klinische Bedeutung der okkulten HBV-Infektion
Mutanten bei okkulter HBV-Infektion. Seit 1975 ist bekannt, dass auch nach Ausheilen einer HBV-Infektion das Virus nicht völlig verschwindet, sondern in versteckter (okkulter) Form in der Leber verbleiben kann. Dort wird es vom Immunsys-tem weitgehend, aber nicht völlig an der Vermehrung gehindert. Aufgrund der kontinuierlichen Selektion durch das Immunsystem sind die okkulten HBV-Varianten meist stark mutiert ohne dabei ihre Virulenz zu verlieren (Abb. 4). Bei sonst gesunden Personen ist aber die Vermehrung so minimal, dass das HBV im Serum selbst mit höchstempfindlichen Methoden der NAT nur selten (<1% der Anti-HBc Positiven) nachweisbar ist. Im Falle einer noch erkennbaren Positivität der HBV DNA ist mit einer Infektiosität bei Blutspenden zu rechnen (Abb. 5). Daher werden in Deutschland alle Blutspender seit 2006 auf Anti-HBc untersucht. Die Virämie ist meist jedoch so gering, das bei sonstigen Expositionen, z.B. bei Bagatellverletzungen oder Intimkontakt) keine Infektionsgefahr besteht.
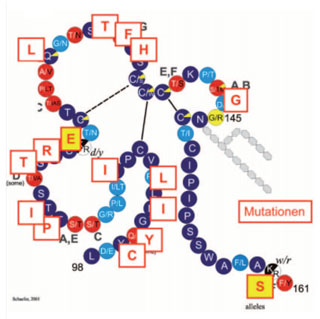
Abb. 6: HBV-Escape-Mutante bei einem Lymphom-Patienten. Modell der HBs-Antigenschleife im kleinen HBV Hüllprotein (HBsAg) von Aminosäure (AS) 98 bis 161. Jeder Kreis entspricht einer Aminosäure mit der Bezeichnung im Einbuchstaben-Code. Dunkelblaue Kreise entsprechen streng konservierten AS, rote sind mit HBV- Genotypunterschieden verbunden, hellblaue sind variabel. (Nach Schaefer et al. in Doerr & Gerlich: Medizinische Virologie, Thieme 2010, S. 356.) Die Rechtecke geben die Mutationen bei einem Fall von HBV-Reaktivierung mit schwerer akuter Hepatitis (ALT 2000 IU/L) nach Überstehen einer Lymphom-Therapie wieder. Die Viruslast war hoch (64.000 Virus-DNA-Moleküle/mL), jedoch war HBsAg mit keinem verfügbaren Test nachweisbar. Vor Therapie hatte der Patient Anti-HBs und Anti-HBc. Gelbe Rechtecke bewirken eine Änderung des HBsAg-Subtyps. Alle 10 sequenzierten Klone hatten die gleiche Sequenz.
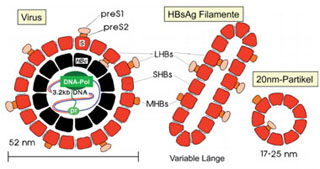
Abb. 7: Aufbau und Bestandteile der HBV- und der subviralen HBsAg-Partikel. Die Virushülle enthält neben dem kleinen (small, S) SHBs-Protein als Hauptkomponente auch mittelgroße MHBs- und großes (large, L) LHBs-Protein, welche sich vom SHBs durch die zusätzlichen PreS1, bzw. PreS2-Domänen unterscheiden. Ein Teil der PreS-Domänen weist nach innen. Die PreS-Domänen werden bei der Negativkontrastierung im Elektronenmikroskop nicht abgebildet, sodass der tatsächliche Durchmesser der Viruspartikel nicht 42-45 nm wie in Abb. 3 sondern eher 52 nm beträgt.
Escape-Mutanten bei HBV-Reaktivierung. Wird das Immunsystem stark supprimiert, z.B. bei Knochenmarktransplantation oder Therapie des Lymphdrüsenkrebses, kommt es oft zur Reaktivierung des HBV, das dann hohe Konzentrationen in Leber und Blut erreichen kann. Zunächst bleibt diese Reaktivierung klinisch stumm. Erholt sich jedoch das Immunsystem, samt seinen noch bestehenden immunologischen Gedächtniszellen gegen HBV, kann es innerhalb von Tagen zur massiven Immunpathogenese und zum Leberversagen kommen (Abb. 5). Bislang glaubte man, dass hauptsächlich die zelluläre Immunität die okkulte HBV-Infektion kontrolliert, aber neuere Beobachtungen zeigen, dass die neutralisierenden Anti-HBs-Antikörper mindestens so wichtig sind. Die Reaktivierungen findet man nämlich am häufigsten bei selektiver Beseitigung der Antikörper-bildenden B-Lymphozyten, z.B. durch den monoklonalen Anti-CD20-Antikörper Rituximab. Hierbei werden Escape-Mutanten gefunden, die bis zu 22 Mutationen im HBsAg aufweisen und durch keinen HBsAg-Test mehr erkannt werden können (Abb. 6, Gerlich et al., 2010). Es ist unwahrscheinlich, dass der herkömmliche Impfstoff gegen solche Mutanten schützt, wenn schon eine Mutation ausreicht, um den Schutz zu verringern.
HBV-Infektion bei HIV-Koinfektion. Während die Fälle von HBV-Reaktivierung infolge einer Immunsuppression in Europa und Nordamerika eher selten und überwiegend Therapie-bedingt sind, ist in afrikanischen Ländern eine Immunschwäche viel häufiger und hauptsächlich durch Infektion mit dem humanen Immundefizienz-Virus (HIV) bedingt. Die HIV-Infektion führt unbehandelt fast immer zu einer tödlich endenden Immundefizienz. Fatalerweise sind insbesondere in Afrika (je nach Region) etwa 15 bis 90% aller HIV-Infizierten gleichzeitig mit HBV infiziert, und viele dieser Patienten haben eine okkulte Form der Hepatitis B. Meistens erfolgt in Afrika die Infektion mit HBV schon in der Kindheit (aber vorwiegend erst nach dem 2. Lebensjahr) und resultiert in einem inapparenten Verlauf ohne HBsAg-Persistenz. In dieser Phase entstehen mutmaßlich intrahepatisch Escape-Mutanten ohne dass es zu einer signifikanten Virämie oder Hepatitis kommt. Wenn nun im Adoleszentenalter HIV hinzu kommt, sind mit zunehmender Immundefizienz die Voraussetzungen für eine Reaktivierung unter häufiger Beteiligung von HBV-Escape-Mutanten gegeben. Die Schutzwirkung des gegenwärtigen Impfstoffs gegen solche Varianten muss in Subsahara-Afrika aufmerksam verfolgt werden, da die dort vorherrschenden Genotypen A1-A7 (außer A2) und E dem Impfgenotyp A2 nur wenig ähnlich sind und so das Escape-Problem verschärfen.
Ziel einer kürzlich begonnenen afrikanisch-deutschen Studie ist es, das Gefährdungspotential durch HBV-Mutanten bei okkulter und reaktivierter Hepatitis B zu untersuchen. Die während der Studie bei afrikanischen HIV-koinfizierten Patienten isolierten Virusstämme sollen am Institut für Medizinische Virologie der JLU Gießen (Leiter: Prof. Dr. John Ziebuhr) molekular- und zellbiologisch charakterisiert werden, um so Rückschlüsse auf das Auftreten von impfungsresistenten Mutanten zu erhalten. Die dabei gewonnenen Erkenntnisse sollten zu gezielten Verbesserungen des derzeitig verfügbaren HBV-Impfstoffs speziell im Hinblick auf Afrika beitragen.
Koordiniert wird die von der Deutschen Forschungsgemeinschaft (DFG) geförderte dreijährige Studie von Glebe und Gerlich am Institut für Medizinische Virologie der Justus-Liebig-Universität Gießen. Auf südafrikanischer Seite wird die Studie geleitet von der Virologin Anna Kramvis von der University of Witwatersrand in Johannesburg. Der Hepatologe Hatim Mudawi vom Institut für Innere Medizin der Universität Khartum in Sudan leitet den sudanesischen Arm der Studie.
Dieses Projekt ist eines von 25 ausgewählten Projekten der „Afrika-Initiative“ der DFG, mit dem Ziel, die wissenschaftliche Kooperation afrikanischer und deutscher Wissenschaftler im Bereich der Infektionsforschung, insbesondere zu vernachlässigten Krankheiten, zu vertiefen. Ein Hauptanliegen ist auch, die wissenschaftliche Infrastruktur und Forschungskapazitäten in den afrikanischen Partnerländern nachhaltig zu stärken.
Weiterentwicklung des HBV-Impfstoffs
Schon lange vor den neuen, besorgniserregenden Beobachtungen zu Lücken im Impfschutz gegen Hepatitis B war bekannt, dass die Impfstoffe der 2. Generation nicht dem Kenntnistand nach 1980 über HBV entsprechen. Insbesondere durch die Arbeiten von Klaus-Hinrich Heermann und Gerlich am Institut für Medizinische Mikrobiologie der Universität Göttingen wurde deutlich, dass das kleine (small) Oberflächenprotein des HBV (SHBs), welches das HBsAg bildet, nur eines von drei Oberflächenproteinen des HBV ist. Das sogenannte mittlere (MHBs) und das große (large) Oberflächenprotein (LHBs) enthalten neben dem Gen-Abschnitt des kleinen Hüllproteins (SHBs) zusätzlich jeweils unterschiedliche Verlängerungen, die sogenannten PräS-Domänen, auf (Abb. 7). Dass die PräS-Domänen schützende Antikörper gegen eine HBV-Infektion induzieren können, zeigten Impfversuche von Alfred Neurath (New York Blood Center) mit chemisch synthetisierten PräS-Peptiden schon Ende der 1980er Jahre an Schimpansen. Als alleiniger Impfstoff sind diese Peptide ungeeignet, da sie zu teuer und wenig immunogen sind. Die naheliegende Einbeziehung aller drei HBV Oberflächenproteine in den bereits bestehenden Hefe-Impfstoff gelang wegen vielfältiger Schwierigkeiten nicht in zufriedenstellender Weise. Erfolgreicher war die Produktion in Säugerzell-Linien durch eine Reihe kleinerer Firmen. Die zunächst in geringer Menge hergestellten PräS-Impfstoffe der 3. Generation zeigten sich in vielen Studien gegenüber den HBV-Impfstoffen der 2. Generation in der Antikörperbildung überlegen. Bislang haben jedoch die großen Impfstoffhersteller aus diesen positiven Entwicklungen keine Konsequenzen gezogen.
Ein möglicherweise noch attraktiveres Konzept ist die Verwendung hoch immunogener künstlicher Trägerpartikel, z.B. der Core-Partikel von HBV, in die gentechnisch die PräS-Antigene an exponierter Stelle eingesetzt wurden (Bremer et al., 2010).
Experimentelle Nachweissysteme
Der eigentliche Schutzmechanismus durch die Impfung lag lange Zeit im Dunkeln. Dies lag daran, dass es kein einfach verfügbares Zellkultursystem gab, an dem der Infektionsvorgang des HBV im Labor untersucht werden konnte. Es gab auch kein einfaches, kleines Tiermodell (z.B. Labor-Mäuse, Ratten), da das HBV nur den Menschen und einige wenige Primaten, wie z.B. den Schimpansen infiziert. Die einzige Möglichkeit bestand in der Verwendung von primären Leberzellkulturen aus frischem menschlichem Lebergewebe, das nach notwenigen Leberoperationen mit Einwilligung der Patienten chirurgisch erhalten werden konnte. Diese Kulturen sind naturgemäß schwierig zu erhalten und ergaben oft wechselnde Ergebnisse. Eine Lösung des Problems ergab sich, als chinesische Forscher entdeckten, dass sich die in China beheimateten „Südost-Asiatischen Spitzhörnchen“ (Tupaia belangeri, Ordnung Scandentia) mit menschlichem HBV infizieren ließen. Die Infektion dieser Tiere, die evolutionär als eine Vorstufe der Primaten betrachtet werden können, war jedoch sehr ineffizient. Weiterführende Studien von Joseph Köck und Kollegen (Freiburg) zeigten, dass sich frisch isolierte primäre Leberzell-Kulturen aus diesen Tieren erstaunlich gut mit HBV infizieren lassen. Diese Befunde konnten rasch von Glebe aufgenommen werden, da an der Universität Gießen bereits eine kleine Tupaiazucht vorhanden war, die früher für die Stressforschung verwendet wurde. Mit Hilfe dieser Leberzellkulturen gelang es Glebe in den letzten Jahren, wesentliche virale und zelluläre Strukturen zu identifizieren, die für die Bindung und Aufnahme des HBV verantwortlich sind (Glebe et al., 2003, Leistner et al., 2008, Bremer et al., 2009). Insbesondere konnte Glebe zusammen mit seinem Heidelberger Kollegen Stephan Urban zeigen, dass ein Abschnitt der PräS1-Domäne auf der HBV-Oberfläche für die erste Kontaktaufnahme des Virus mit seiner Zielzelle wesentlich ist (Glebe et al., 2005). Die Bedeutung dieses international anerkannten HBV-Infektionssystems geht weit über die Grundlagenforschung hinaus und erlaubt neben der Charakterisierung von HBV-Impfdurchbrüchen ebenso die Testung und Validierung von Desinfektionsmitteln und Inaktivierungsverfahren für HBV und die Entwicklung neuartiger antiviraler Medikamente für eine Verbesserung der Therapie von chronisch HBV-infizierten Patienten.
Mit Hilfe dieser Befunde ist es den Gießener Virologen Bremer und Glebe gelungen, Komponenten des LHBs für einen zukünftigen HBV-Impfstoff der 4. Generation zu identifizieren, die auch gegen HBsAg-Escape-Mutanten schützen sollten und im Tierversuch Antikörper mit sehr hoher Schutzwirkung erzeugten (Bremer et al., 2010). Des Weiteren wurde in Zusammenarbeit mit Paul Pumpens, Riga und Henrik Garoff, Karolinska-Institut, festgestellt, dass das in Hefe produzierte HBsAg nicht alle Schutz-erzeugenden Strukturen (neutralisierende Epitope) enthält, die natürliches oder in Säugerzellen mittels eines viralen Vektors produziertes HBsAg aufweist. Fatalerweise scheinen den Hefe-Antigenen vorwiegend die Epitope zu fehlen, die einen Genotyp-übergreifenden Schutz bewirken (Niedre-Otomere et al., 2010). Dies könnte auch die oben erwähnte schwächere Wirkung des Normalimpfstoffs gegen die anderen HBV-Genotypen erklären.
Impfstudie in Palästina und Israel
Die Bedeutung eines optimal wirksamen HBV-Impfstoffs ist besonders vor dem Hintergrund eines hohen Prozentsatzes an chronisch-infizierten Patienten wesentlich. Während in Deutschland nur 0,5% der Bevölkerung chronisch mit HBV infiziert sind, liegt in Palästina die Häufigkeit bei 8%. HBV wird vor allem während der Geburt von der infizierten Mutter auf ihr Neugeborenes übertragen, das dann fast immer auch eine chronische Infektion entwickelt und ein sehr hohes Risiko hat, im mittleren Lebensalter an Leberversagen oder Leberkrebs zu versterben. Die momentan verfügbaren HBV-Impfstoffe der 2. Generation versagen jedoch in Palästina bei bis zu 25% der Neugeborenen von infizierten Müttern. In einer vor kurzem von Glebe und Gerlich begonnenen Studie wird daher im direkten Vergleich mit dem Impfstoff der 2. Generation bei der Hälfte der Neugeborenen ein in Israel und Palästina zugelassener Impfstoff der 3. Generation verwendet, der Antikörper gegen alle drei HBV Oberflächenproteine erzeugt und bei Kleinkindern eine erwiesenermaßen sehr gute Schutzwirkung gezeigt hat. Hierdurch besteht erstmals die Möglichkeit die mutmaßliche Überlegenheit der 3. Generation nicht nur durch die Anti-HBs-Spiegel sondern durch die Schutzrate im Feld zu beweisen. Auf palästinensischer Seite wird die Studie von Maysa Azzeh an der Al-Quds Universität, Ost-Jerusalem-Abu Dies, geleitet und in sechs Geburtszentren in der Westbank durchgeführt. Rifaat Safadi (Hadassah Universität, Jerusalem) leitet den israelischen Arm der Studie in vier Geburtszentren in Jerusalem und Nazareth. Finanziert wird die Studie von der Deutschen Forschungsgemeinschaft (DFG) im Rahmen der „Trilateralen Projekte“, die laut DFG unter Beteiligung von deutschen, israelischen und palästinensischen Wissenschaftlerinnen und Wissenschaftlern auch der Unterstützung einer friedlichen Entwicklung im Nahen Osten dienen sollen.
Schlussbemerkung. Niemanden sollten die kritischen Anmerkungen dieses Beitrags davon abhalten, die Hepatitis B Impfung mit den bisherigen Impfstoffen zu empfehlen bzw. sich selbst impfen zu lassen, so lange keine erprobten besseren Alternativen verfügbar sind. Um auf lange Sicht HBV weltweit quasi auszurotten, werden jedoch wirksamere Impfstoffe nötig sein.
Literatur beim Verfasser





