 The Liver Meeting, Boston, 30. Oktober bis 3. November 2009
The Liver Meeting, Boston, 30. Oktober bis 3. November 2009
Neue Substanzen, neue Strategien und viele spannende Details
Insgesamt wurden nahezu 2.000 Arbeiten präsentiert. Im Mittelpunkt standen die neuen Substanzen zur Behandlung der Hepatitis C. Die Pipeline ist gut gefüllt. Fast jedes Pharmaunternehmen hat eine oder mehrere Substanzen in der Prüfung und es gab eine kaum überschaubare Flut von Arbeiten. Am weitesten entwickelt sind Telaprevir und Boceprevir. Hier geht es aktuell in erster Linie um die Therapiedauer, den Nutzen einer Lead-in Phase und das Dosierungsintervall. Offenbar reicht bei Telaprevir eine Therapiedauer von 12 Wochen Triple-Therapie, gefolgt von 12 bzw. 24 Wochen pegIFN/Ribavirin. Unter diesem Regime erreichten in PROVE 1 und 2 (gepoolte Daten) 65% der therapienaiven Patienten mit HCV GT1 eine SVR im Vergleich zu 44% unter Standardtherapie. Insbesondere profitierten auch die schwer zu therapierenden Patienten mit hoher Viruslast (63% vs. 39%) oder Leberfibrose (61% vs. 30%) und die Älteren (59% vs. 29%) signifikant von der Dreifachtherapie (Everson GT et al. #1565). In PROVE 3, in der Therapieversager behandelt wurden, zeigte die abschließende Auswertung ebenfalls ein positives Bild. Unter 12 Wochen TVP/pegIFN/RBV und 24 bzw. 48 Wochen pegIFN/RBV fanden sich erfreulich hohe SVR-Raten im Vergleich zur Standardtherapie, nämlich Relapser 69% vs. 76% vs. 42%, Nullresponder 39% vs. 38% vs. 11%, früherer viraler Durchbruch 57% vs. 63% vs. 36%. Weniger als 10% in dieser Studie waren Afroamerikaner (McHutchison JG et al. #66).

Telaprevir: Zweimal täglich geht auch
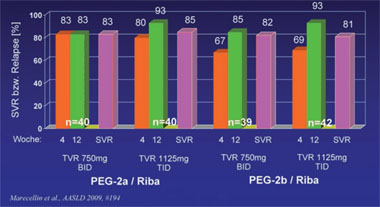
Abb. 1: Telaprevir Ersttherapie. BID vs. TID und PEG2a vs. PEG2b, GT1
In der offenen vierarmigen Studie C208 (n=161) wurden wichtige, praxisrelevante Fragen zu Telaprevir untersucht. Ist Telaprevir dreimal täglich genauso wirksam wie zweimal täglich? Und kann die Substanz gleichermaßen mit Peginterferon alpha-2a und -2b kombiniert werden? Die Antworten lauten zweimal ja. Nach 12 Wochen Triple-Therapie plus 12 Wochen pegIFN/RBV erreichten über 80% der Patienten eine SVR und zwar unter allen Regimen (Abb. 1). Die meisten Patienten wurden insgesamt 24 Wochen behandelt. Lediglich 29 Patienten (18%) wurden 48 Wochen therapiert. Die häufigsten Nebenwirkungen waren Exanthem, Juckreiz, Anämie und Übelkeit. Sie waren in beiden Gruppen gleich verteilt. Aufgrund von Nebenwirkungen brachen nur 11 Patienten die Behandlung ab. Abbrüche wegen Hautausschlag waren deutlich seltener als in früheren Studien, was dafür spricht, dass die Behandler gelernt haben, diese Nebenwirkung besser zu managen. Bei 14 Patienten kam es zum virologischen Durchbruch, meist in den ersten 3 Wochen (9/14) und meist bei Gentyp 1a (11/14). Neue Resistenzmutationen wurden nicht beobachtet (Marcellin P et al. #194).
Boceprevir: Wirkt auch bei Nullrespondern
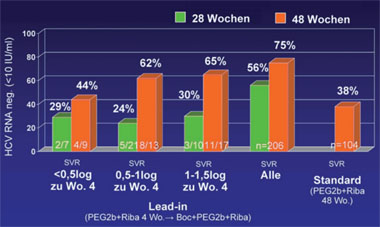
Abb. 2: SPRINT-1: Boceprevir Ersttherapie nach Lead-in. SVR-Raten in Abhängigkeit vom Ansprechen auf PegInterferon und Ribavirin in der Lead-in Phase
Boceprevir wird voraussichtlich nach Telaprevir der zweite Proteasehemmer auf dem Markt sein. Er wurde in SPRINT-1 geprüft, einer Phase-2-Studie an knapp 600 therapienaiven Patienten. Jetzt wurden die Daten der 206 Patienten mit einem vierwöchigen Lead-in mit pegIFN/RBV retro-spektiv genauer analysiert. 159/209 Patienten hatten in den ersten vier Wochen unter pegIFN/RBV einen Abfall <1.0 log10 IU/ml. Von diesen Nullrespondern erreichten 38% schließlich doch eine SVR und zwar 55% nach einer 44wöchigen Triple-Therapie und 25% nach 24 Wochen Triple-Therapie. Von den Patienten, die beim Lead-in eine RVR erreichten, war die SVR nicht abhängig von der anschließenden Therapiedauer (94% vs. 82%). Dagegen profitierten die Patienten ohne RVR deutlich von der Therapieverlängerung (79% vs. 21%). Die SVR in der Kontrollgruppe lag bei 38% (Abb. 2). Daraus schließen die Autoren, dass das Ansprechen in der Lead-in Phase ebenso wie die RVR möglicherweise eine Individualisierung der Therapie erlaubt. Spezifische Nebenwirkungen von Boceprevir wurden nicht beobachtet. Der Einsatz des Proteasehemmers war allerdings mit einem Hämoglobin-Abfall von rund 1 g/dl verbunden (Kwo PY et al. #62 und #1582).
Narlaprevir und BI 201335: 12-Wochen-Daten
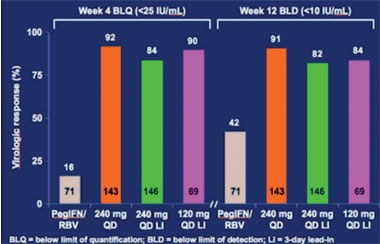
Abb. 3: BI 201335. RVR- und EVR-Raten
Für die Nachfolger von Telaprevir und Boceprevir laufen bereits die ersten Phase-2-Studien. Vorgestellt wurden 12-Wochen-Daten zu BI 201335 und Narlaprevir, die beide nur einmal täglich eingenommen werden müssen. In der Studie SILEN-C1 wird der neue Proteasehemmer BI 201335 des Unternehmens Boehringer Ingelheim geprüft. Die 427 therapienaiven Patienten erhalten in der vierarmigen Untersuchung 24 Wochen Triple-Therapie (zwei Arme mit 3-tägigem Lead-in pegIFN/RBV) und anschließend 24 bzw. 48 Wochen Standardtherapie. Präsentiert wurde die erste Auswertung nach 12 Wochen. Eine RVR erreichten im Vergleich zur Standardtherapie maximal 92% vs. 16% der Patienten (HCV-RNA <25 IU/ml) und eine EVR nach 12 Wochen maximal 91% vs. 42% (HCV-RNA <10 IU/ml) (Abb. 3). Zum virologischen Durchbruch kam es in den ersten vier Wochen bei 2-3%, in den folgenden 8 Wochen bei bis zu 1,4% der Patienten. Im Hinblick auf die Verträglichkeit wurden neben gastrointestinalen Beschwerden selten Exantheme, aber unter der höheren Dosierung bei bis zu 20% der Patienten ein Ikterus beobachtet. Der Proteasehemmer kann bekanntermaßen innerhalb der ersten zwei Wochen zu einem dosisabhängigen Anstieg des unkonjungierten Bilirubins führen. Der durchschnittliche Anstieg in der Studie lag zwischen 0,6 und 1,5 mg/dl, maximal 9,1 mg/dl (Sulkowski MS et al. #LB3).
Narlaprevir, die Folgesubstanz von Boceprevir aus dem Haus Schering Plough, wird mit Ritonavir geboostert, d.h. Ritonavir behindert den Abbau von Narlaprevir in der Leber und führt so zu einer höheren Medikamentenexposition. In der Studie werden 111 therapienaive Patienten 12 Wochen lang mit Narlaprevir plus pegIFN/RBV (2 Arme mit 4 Wochen Lead-in pegIFN/RBV) und dann 36 Wochen mit Standardtherapie behandelt. Eine RVR erreichten im Vergleich zur herkömmlichen Behandlung in den Narlaprevir-Armen bis zu 87% vs. 0% der Patienten, eine EVR 87% vs. 17% (HCV-RNA <10 IU/ml). Die vierwöchige Vorbehandlung mit pegIFN/RBV hatte einen günstigen Einfluss auf die RVR, nicht jedoch auf die EVR. Nullresponder in der Lead-in Phase sprachen gleichermaßen günstig auf die Triple-Therapie an, bei 2/11 kam es jedoch im weiteren Verlauf zum virologischen Durchbruch. Die Verträglichkeit war gut, lediglich Anämie und Benommenheit wurden häufiger beobachtet (JM Vierling et al. #LB4).
Erste Therapie ohne Interferon
IL28B-Polymorphismus als Prädiktor für SVR
Patienten mit einem CC-Genotyp für IL28B erreichen deutlich häufiger eine SVR als Patienten mit TT. Möglicherweise ist dies die Erklärung für das schlechtere Ansprechen von Afroamerikanern, denn 37% von ihnen haben den ungünstigen Genotyp. Ein kommerzieller Test wird bereits entwickelt und dürfte auch für Weiße interessant sein, denn auch bei diesen Patienten beträgt der Unterschied in der SVR zwischen den Genotypen CC und TT rund 50%.
Thompson AJ et al. #LB5
HIV allein kein negativer Prädiktor bei LTX
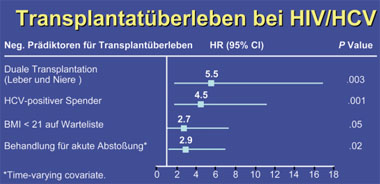
In einer gemeinsamen Analyse von 18 amerikanischen Transplantationszentren lag das 1- bzw. 3-Jahresüberleben für die transplantierte Leber lag bei HIV/HCV-Koinfizierten bei 71% und 59%, bei Monoinfizierten 86% und 67%. Signifikante negative Prädiktoren bei den Koinfizierten waren ein niedriger BMI (<21), eine HCV-positive Spenderleber, eine duale Leber-Nieren-Transplantation und eine behandelte Abstoßung. Die kumulative Indizienz für eine schwere HCV-Reinfektion betrug bei den Koinfizierten 18%, bei den Monoinfizierten 8%, wobei der einzige Prädiktor für das schwere HCV-Rezidiv eine behandelte Abstoßung war und nicht der HIV-Status.
Terrault N et al. #195
Atemtest für Leberfunktion
Nach oraler Gabe von radioaktiv markiertem 13C Methacetin wird dieses von der Leber in verstoffwechselt und 13 CO2 in der Atemluft gemessen. Je langsamer 13 CO2 in der Atemluft erscheint, umso schlechter ist die Leberleistung. Dieses nichtinvasive Verfahren korrelierte in einer Studie an 395 Patienten sehr gut mit dem MELD-Score und der Prognose. Sollten sich die Ergebnisse bestätigen, könnte der Parameter in den MELD-Score aufgenommen werden.
Lalazar G et al, # 96
Rechte Randspalte
Missachten der Stoppregeln – gut oder schlecht?
Deutsche Ärzte folgen den Leitlinien immer besser, wenn es um die Messung der HCV-RNA zu Woche 12 und 24 geht. Doch sie missachten die Stoppregeln. In einer deutschen prospektiven Patientenkohorte wurde die Mehrzahl der Patienten ohne EVR weiterbehandelt, ebenso Patienten, die zu Woche 24 noch HCV-positiv waren. Die SVR-Raten dieser Patienten waren erstaunlicherweise 5- bis 10-mal höher als in der Literatur angegeben.
Niederau C et al. #873
Verlauf der akuten Hepatitis C bei HIV
In einer britischen Studie wurden die Daten von 100 HIV-Patienten mit akuter Hepatitis C ausgewertet, die im Schnitt 3 Jahre lang mindestens einmal alle drei Monate zur Kontrolle kamen. Bei 16% der Patienten heilte die Hepatitis C spontan aus, bei 84% wurde sie chronisch. Letztere Gruppe zeigte fluktuierende HCV-RNA-Spiegel (37%), bei denen ein initialer Abfall der HCV-RNA von einem Anstieg >1 log gefolgt wurde. Die Spontanheilung war dagegen mit einem Abfall der HCV-RNA >1,7 log innerhalb von 100 Tagen, einer höheren CD4-Zahl (650 vs 520/µl) und einem höheren maximalen Bilirubin (23 vs 18 g/dl). Zur Superinfektion kam es bei 40% der Patienten.
Holubar M et al. #83
Nutzen der HCV-Therapie
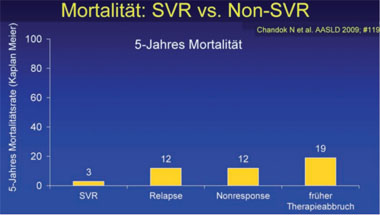
Klare Belege für den Nutzen der Therapie der Hepatitis C liefert eine Analyse der Daten aller Patienten (n=515) der amerikanischen Mayo-Klinik, die in den letzten 8 Jahren behandelt wurden. Die 5-Jahres-Mortalität war bei den Patienten mit SVR mit 3% am geringsten, bei den Therapieabbrechern mit 19% am höchsten. 19 Patienten ohne Zirrhose mussten behandelt werden, um einen Todesfall zu vermeiden.
Chandok N et al. #119
Das Highlight des Kongresses war die Präsentation der ersten Daten der Studie INFORM-1, in der erstmals eine Interferon-freie, orale, zweimal tägliche Therapie geprüft wird. In der Untersuchung wird das Nukleosid R7128 mit hoher Resistenzbarriere mit dem Proteasehemmer R7227 mit niedriger Resistenzbarriere, aber hoher antiviraler Wirksamkeit kombiniert. Unter der Therapie kam es innerhalb von 14 Tagen bei 73/74 Patienten zu einem kontinuierlichen Abfall der Viruslast. Bei einem Patienten kam es zum viralen Durchbruch, Resistenzen wurden aber nicht beobachtet. Unter der höchsten Dosierung (Polymerasehemmer R1728 1.000 mg plus Proteasehemmer R7227 600 mg BID) fiel die HCV-RNA innerhalb der ersten 14 Tage um 4,8 bis 5,2 log. Bei 63% der Patienten lag die HCV-RNA unter der Nachweisgrenze von 40 IU/ml (Abb. 4). Die Verträglichkeit war gut, kein Patient brach wegen Nebenwirkungen ab und in keinem Fall musste die Dosierung reduziert werden.
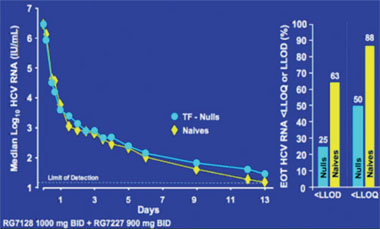
Abb. 4: : INFORM-1. Unter der Kombination eines Proteasehemmers und Polymerasehemmers fällt die HCV-RNA bei Interferon-naiven und Interferon-Nullrespondern gleichermaßen stark ab
Die Phase 2 der klinischen Prüfung soll Anfang 2010 beginnen, vermutlich nicht in den USA, da die amerikanische FDA direkt antivirale Therapien ohne Interferon nur über 14 Tage erlaubt, aus Angst vor Resistenzen (Gane EJ et al. #193).
Albinterferon: Sicherheit bestätigt
Auch ein neues Interferon steht kurz vor der Zulassung. Albinterferon ist ein rekombinantes Molekül aus humanem Albumin und pegyliertem Interferon-alpha 2b, das nur einmal alle zwei Wochen gespritzt werden muss. In den Phase-3-Studien ACHIEVE-1 und -2 wurden zwei Dosierungen AlbIFN 900 µg qw2 und 1.200 µg qw2 gegen pegIFN-2a jeweils in Kombination mit Ribavirin an 1.331 Patienten mit HCV Genotyp 1 bzw. 2/3 geprüft. Die SVR-Raten waren in beiden Studien vergleichbar. Unter dem neuen Interferon wurden nach einiger Zeit häufiger interstitielle Lungenerkrankungen (ILD) beobachtet. Aus diesem Grund wurden bei 753/1.323 (57%) Patienten mit GT1 und 654/932 (70%) mit GT 2/3 eine Röntgenaufnahme gemacht. Diese sowie alle weiteren Befunde zum Thema wurden dann von einem verblindeten, unabhängigen Expertengremium überprüft. Es zeigte sich, dass Albinterferon keinen ungünstigen Effekt auf die Lunge hat. Lungenerkrankungen waren in allen Gruppen gleich häufig (4,5% vs 4,3% vs 4,8%) und zwar bei Patienten mit und ohne Husten, mit und ohne Dyspnoe und mit und ohne Rauchen aktuell oder in der Vorgeschichte (Sulkowski MS et al. #64, Benhamou Y et al. #1567, McHutchinson JG et al. #1572).
Ribavirin: Was bringt Lead-in?
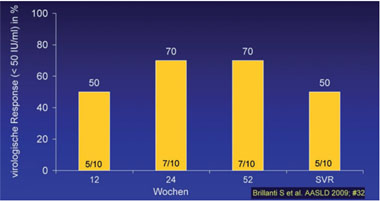
Abb. 5: Vier Wochen Ribavirin Lead-in erhöht das Ansprechen bei Nonrespondern
Ribavirin gilt als ein wichtiger Pfeiler des Therapieerfolges, wobei eine höhere Dosis bzw. ein höherer Abfall des Hämoglobins unter der Therapie als günstiger Prädiktor gilt. Dies wurde von australischen Arbeitsgruppen bestätigt. In der großen CHARIOT-Studie an rund 700 Patienten mit HCV GT1 erreichten signifikant mehr Patienten eine SVR mit einem Hb-Abfall von jemals >3 g/dl (54% vs. 46%) bzw. einem Hb >10 g/dl (61% vs. 50%) (Sievert W et al. #1557).
Mit dem Effekt eines
„Ribavirin-Primings“ beschäftigten sich zwei Arbeiten. In einer Pilotstudie
wurden 10 konsekutive
Nonresponder auf mindesten 12 Wochen Therapie im Rahmen
einer Retherapie zunächst vier Wochen lang mit 1.000-1.200 mg RBV und dann 52
Wochen mit Standardtherapie behandelt. Nach 12 Wochen lag die HCV-RNA bei 5
Patienten <40 IU/ml, sieben erreichten eine EOT und 5 eine SVR (Brillianti S
et al. #32) (Abb. 5). Auf welche Weise die Ribavirin-Vorbehandlung den
Therapieerfolg günstig beeinflussen könnte, ist unklar. Eine NIH-Arbeitsgruppe
fand nach vierwöchiger Ribavirin-Monotherapie zwar interessanterweise einen
Abfall der HCV-RNA um 0,7 log, aber keine Veränderung der viralen Kinetik unter
der anschließenden Standardtherapie (Noureddin M et al. #835). Dagegen
schnitten HIV/HCV-Koinfizierte (n=410) unter peg/IFN plus 800 mg vs.
1.000-1.200 mg gleich gut ab (SVR 19% vs. 22%, Weiße 32% vs. 28%, Abbrüche 57%
vs. 59%) (Rodriguez-Torres M et al. #1561).
Was bringt Interferon Lead-in?
In der PROGRESS-Studie wurde die Wirksamkeit einer doppelten Dosis pegIFN in den ersten 12 Wochen sowie von hochdosiertem Ribavirin (1.400-1.600 mg) geprüft. Von diesem Ansatz scheinen die schwer zu behandelnden Patienten mit Übergewicht (96 kg), NASH und hoher Viruslast (3 Mio IU/ml) zu profitieren. Sie erreichten häufiger eine SVR als im Vergleich zur Standardtherapie, wobei der Unterschied zwischen Interferon-Induktion oder hochdosiertem Ribavirin oder beidem nicht stark ausgeprägt war. Die Verträglichkeit der intensivierten Therapie war mit der Standardtherapie vergleichbar (Reddy KR et al. #61).
Keine Angst vor Neutropenie
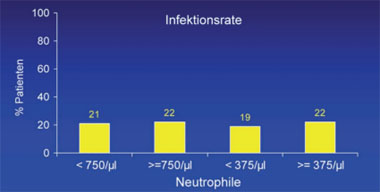
Abb. 6: Infektionen sind bei Patienten mit Neutropenie nicht häufiger
Laut einer retrospektiven Analyse der Daten von 321 Patienten eines Zentrums in Rotterdam führt eine Neutropenie nur selten zu Infektionen. Bei 30% der Patienten fiel die Zahl der Neutrophilen unter Standardtherapie <750/µl und bei 5% <375/µl. Bei 22% der Patienten wurden Infektionen beobachtet, 14% davon waren schwere Infektionen. Bei 6% wurde die Interferon-Dosis wegen der Neutropenie reduziert, 4 Patienten (1%) haben aus diesem Grund abgebrochen. Infektionen wurden bei den Patienten mit Neutropenie nicht häufiger beobachtet. Vielmehr korrelierte die Infektionsrate mit dem Alter, einem Diabetes sowie Leberzirrhose (Abb. 6) (Roomer R et al. #33).
Hepatitis B
Bei der chronischen Hepatitis B sieht das Bild ganz anders aus als bei der Hepatitis C. Neue Substanzen sind aktuell nicht in greifbarer Nähe. Präsentiert wurden in erster Linie Langzeitdaten und Details zu den bekannten Nukleos(t)iden sowie Erfahrungen bei besonderen Patientengruppen. Im Mittelpunkt des wissenschaftlichen Interesses scheint als neuer Endpunkt die „Ausheilung“ der Hepatitis B zu stehen.
Gute Langzeitwirksamkeit
Unter Tenofovir sind rund 95% der HBeAg-positiven und 87% der HBeAg-negativen Patienten der Zulassungsstudien 102 und 103 auch nach drei Jahren Therapie noch unter der Nachweisgrenze. Resistenzen wurden nicht beobachtet (Marcellin P et al. #481; Heathcote EJ et al. #483). Eine ähnlich gute Wirksamkeit zeigt sich im klinischen Alltag. Laut Florian van Bömmel, Berlin, der Daten aus 19 europäischen Zentren präsentierte, haben hier ebenfalls rund 92% der Patienten eine nicht nachweisbare HBV-DNA und keine Resistenz. 94% der 174 HBeAg-positiven bzw. -negativen Patienten waren vorbehandelt (van Bömmel F et al. #221).
Zu Entecavir wurden ebenfalls Daten aus dem klinischen Alltag präsentiert. In Mailand waren 376 konsekutive Patienten mit Entecavir behandelt worden. 84% der Patienten aus 16 italienischen Zentren waren HBeAg-negativ, 47% hatten bereits eine Leberzirrhose. Nach 48 Wochen lag die HBV-DNA bei rund 80% der Patienten mit einer Ausgangsviruslast von >8 Logstufen unter der Nachweisgrenze von <12 IU/ml. Nach zwei Jahren hatten 96% der Patienten dieses Ziel erreicht. Insgesamt sieben Patienten benötigten ab Woche 48 zusätzlich das Nukleotidanalogon Tenofovir. Bei vier Patienten stieg die Viruskonzentration wieder, eine Resistenz gegen Entecavir konnte aber nicht nachgewiesen werden (Lampertico P et al. #220).
Zu Telbivudin wurden vier-Jahres-Daten der GLOBE-Studie präsentiert. Hier zeigten 92% der Patienten, deren Viruslast zu Woche 24 negativ waren, eine HBV-DNA <300 Kopien/ml. Insgesamt hatten von den weiter verfolgten Patienten 84% der HBeAg-negativen und 79% der HBeAg-positiven Patienten eine nicht nachweisbare Viruslast (Wang Y et al. #482).
Dekompensierte Leberzirrhose
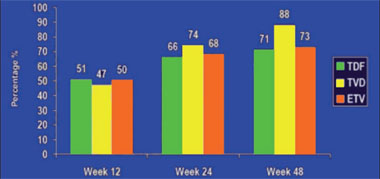
Abb. 7: Tenofovir vs. Tenofovir/Emtricitabin vs. Entecavir bei Leberzirrhose-Patienten. Anteil der Patienten mit nicht nachweisbarer HBV-DNA. ITT-Analyse
Der Effekt von Tenofovir, der Fixkombination Tenofovir/Emtricitabin oder Entecavir bei Patienten mit dekompensierter Leberzirrhose wurde in einer internationalen Studie untersucht. 84% der Teilnehmer waren Männer, 54% waren Asiaten, das mittlere Alter lag bei 52 Jahren, der Child-Pugh-Score bei 7 und der MELD-Score bei 9,5. Ein Drittel hatte eine eingeschränkte Nierenfunktion mit einer Kreatinin-Clearance <80 ml/Min. Die virologische Wirksamkeit, der Effekt auf die Leberfunktion und die Verträglichkeit der drei Therapieoptionen waren vergleichbar. Nach 48 Wochen lag die HBV-DNA bei 71%, 88% bzw. 73% der Patienten <400 Kopien/ml (Abb. 7). Bei den vorbehandelten Patienten mit LAM-Resistenz schnitt Tenofovir erwartungsgemäß besser ab (50% vs. 89% vs. 33%). Eine HBeAg-Serokonversion wurde bei 21%, 13% und 0% beobachtet und ein „Versagen“ aufgrund von Verträglichkeitsproblemen hatten 7%, 4% und 10% der Teilnehmer (Y Liaw et al. #122).
Serokonversion
Das neue Ziel der Therapie der Hepatitis B ist neben der Suppression der Virusreplikation auch die immunologische Kontrolle der Erkrankung, gemessen an der HBe- und HBsAg-Serokonversion. Dieses Ziel scheint zumindest bei einem Teil der Patienten mit komplett supprimierter Viruslast erreichbar, wenn man sie nur lange genug behandelt. In den Nukleos(t)id-Studien steigt die Rate der HBsAg-Verluste und -Serokonversionen mit der Zeit langsam, aber kontinuierlich. Auf der Suche nach Prädiktoren für die Serokonversion scheint das quantitative HBsAg ein guter Marker zu sein.
Entecavir beispielsweise hatte in der Phase-3-Studie BMS 022 zu Woche 120 bei 5,1% der HBeAg-Positiven zum HBsAg-Verlust geführt im Vergleich zu 2,8% unter Lamivudin. Interessanterweise waren es unter beiden Medikamenten gleichermaßen vor allem Patienten mit HBV-Genotyp A und D (7,1% und 8,1%), während Patienten mit Genotyp B und C (2,1% und 0,5%) deutlich schlechter abschnitten (Gish RG et al. #388).
Unter Tenofovir, das bei HIV/HBV-Koinfizierten ja schon seit längerem eingesetzt wird, kam es bei dieser Patientengruppe nach fünf Jahren in einer holländischen Arbeit bei rund 12% und in einer österreichischen Untersuchung bei 11% zum HBsAg-Verlust (Reijnders JG et al. #425, Kosi LM et al. #391).
In der GLOBE-Langzeitbeobachtung hatten unter Telbivudin im dritten Jahr 7% der Patienten HBsAg verloren (5,6% HBeAg-positiv, 1,4% HBe-negativ) und bei 3,1% bzw. 0,7% wurde eine HBsAg-Serokonversion dokumentiert (Wursthorn K et al. #487).
HBsAg als Prädiktor
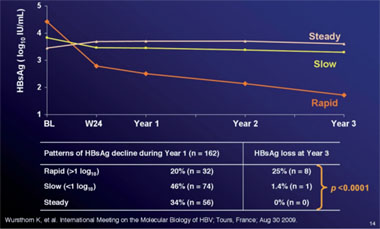
Abb. 8: HBsAg-Kinetik unter drei Jahren Telbivudin. Man erkennt drei Muster, wobei der rasche Abfall bis zu Woche 24 signifikant mit dem konsekutiven HBsAg-Verlust korreliert
Ähnlich auch wie in früheren Studien war das quantitative HBsAg auch unter Telbivudin ein Prädiktor für den HBsAg-Verlust. In einer Substudie von GLOBE zeigten HBV-Viruslast und HBsAg-Konzentration initial eine enge Korrelation und zwar sowohl bei den HBeAg-positiven wie -negativen Patienten (p<0,001) und im Verlauf der Telbivudin-Therapie fiel der HBsAg-Spiegel in beiden Gruppen im Lauf der drei Jahre kontinuierlich ab. Zwischen den HBeAg-Positiven und -Negativen wurden allerdings Unterschiede beobachtet. Bei den HBeAg-positiven Patienten war der Abfall bereits im ersten Jahr besonders ausgeprägt, während der steilste Abfall bei den HBeAg-Negativen im zweiten und dritten Jahr der Behandlung beobachtet wurde. Zudem waren bei den Patienten mit und ohne HBsAg-Verlust bereits in den ersten 24 Wochen unterschiedliche kinetische Muster erkennbar, wobei ein rascher Abfall >0,5 log IU/ml hochsignifikant mit dem HBsAg-Verlust korrelierte (Abb. 8) (Wursthorn K et al. #487). In machen Studien wurden andere Cut-offs gemessen. In der Studie mit PegInterferon alpha-2a beispielsweise hatten 62% der Patienten mit einem HBsAg <1.000 IU/ml sechs Monate nach Therapiebeginn fünf Jahre später HBsAg verloren im Vergleich zu 21% mit einem HBsAg-Spiegel über diesem Wert (Marcellin P et al. #387).
Verträglichkeit und Sicherheit
Generell ist die Verträglichkeit und Sicherheit der Nukleos(t)ide sehr gut. Doch wie sieht es unter Langzeitgabe aus? Und wie steht es mit seltenen Nebenwirkungen? Mit dieser Frage beschäftigten sich zahlreiche Arbeiten. Unter Tenofovir beispielsweise kann es zu einem Anstieg des Kreatinins und einem Abfall des Phosphats kommen. In den Tenofovir-Zulassungsstudien 102 und 103 wurde allerdings innerhalb von drei Jahren ein Kreatinin-Anstieg >0,5 mg/dl und ein Phosphat <2 mg/dl nur bei jeweils <1% der Patienten beobachtet (Marcellin P et al. # 481; Heathcote EJ et al. #483). Bei HIV/HBV-koinfizierten Patienten beschrieb eine holländische Arbeitsgruppe einen signifikanten Abfall der glomerulären Filtrationsrate innerhalb von fünf Jahren von 105 auf 94 ml/Min. 9% der Patienten entwickelten eine Nierenfunktionsstörung und 3 Patienten (n=102) mussten die Therapie deshalb abbrechen (Reijnders JG et al. #425). Möglicherweise kann Tenofovir auch bei Patienten mit suboptimalen Vitamin-D-Spiegeln und verminderter Kalziumaufnahme zu einem sekundären Hyperparathyreoidsmus führen und damit einer Osteoporose Vorschub leisten (Constable C et al. #451).
Unter Telbivudin waren in der Langzeitstudie in den vier Beobachtungsjahren Erhöhungen der Kreatinkinase bei 16% der Patienten am häufigsten. Diese war jedoch bei 68% einmalig und vorübergehend und kein zuverlässiger Indikation für eine Muskelstörung, denn lediglich 29% der Patienten mit muskulären Nebenwirkungen und nur 36% derer mit Muskelbeschwerden hatten eine erhöhte Kreatinkinase. Insgesamt waren Muskel-assoziierte Nebenwirkungen mit 4,1% selten und eine Myopathie bzw. Myositis mit 1,1% noch seltener. Veränderungen der Nierenfunktion wurden nicht beobachtet (Avila C et al. #472).
Entecavir: Laktazidose bei Patienten mit schlechter Leberfunktion
Unter Entecavir wurden an der Universität Frankfurt bei Patienten mit stark eingeschränkter Leberfunktion schwere Laktazidosen beobachtet. 5/16 Patienten mit fortgeschrittener Leberzirrhose hatten ein Laktat von 40-200 mg/dl und einen pH von 7,02-7,35. Die Laktazidose trat innerhalb von vier bis 240 Tagen nach Therapiebeginn auf und alle Patienten hatten einen MELD ≥20. Bei drei Patienten war die Laktazidose ausgeprägt (<7,3). Ein Patient verstarb, bei den anderen bildete sich die Laktazidose nach Absetzen von Entecavir zurück (Lange CM et al. #217).





