Hartwig Klinker, Würzburg
Ribavirin – Strategien zur Verbesserung des Therapieerfolges
Die Einführung von Ribavirin (RBV), einem erstmalig bereits 1972 synthetisierten Guanosinanalogon, in die antivirale Behandlung der chronischen Hepatitis C Ende der 90er Jahre hat die Therapieergebnisse entscheidend verbessert, wenngleich der exakte Wirkmechanismus der Substanz in Bezug auf die HCV-Infektion nach wie vor nicht vollständig aufgeklärt ist (Parker, 2005).
Exposition und Ansprechen
Untersuchungen einer spanischen Arbeitsgruppe zeigen, dass für das frühe virologische Ansprechen in Woche 12 (early virological response = EVR) neben dem Vorliegen eines HCV-Genotyp 3 die Ribavirin-Exposition als unabhängiger Prädiktor eine entscheidende Rolle spielt (Núñez et al., 2005). Eine vergleichende Analyse der PRESCO-Studie (Ribavirina España Coinfección, HCV/HIV-Koinfektion), eines HCV-monoinfizierten Patientenkollektivs (PISG = Pegasys International Study Group) und der koinfizierten Patienten aus der APRICOT-Studie (AIDS Pegasys Ribavirin Coinfection Trial) belegt ebenfalls, dass eine hohe Ribavirin-Dosis das frühe virologische Ansprechen günstig beeinflusst (Ramos et al., 2007). Bereits die Ribavirin-Exposition am ersten Behandlungstag lässt Rückschlüsse auf ein anhaltendes Therapieansprechen zu (Loustaud-Ratti et al., 2008).
Mögliche Ansätze
Aufgrund der bisher publizierten Daten sowie eigener Untersuchungen kann eine Messung der RBV-Plasmakonzentration bei Risikopatienten für besonders niedrige oder hohe RBV-Konzentrationen (ältere Patienten, Patienten mit fortgeschrittener Niereninsuffizienz, Patienten mit HCV/HIV-Koinfektion unter HAART, stark übergewichtige Patienten u.a.) eine sinnvolle Maßnahme zur Verbesserung der Therapieeffizienz und auch der Therapiesicherheit sein. Relevant scheint die Erhebung pharmakokinetischer Daten vor allem in der Therapieführung von Patienten mit HCV-Genotyp 1-Infektion zu sein.
Die allgemeinen Anforderungen an ein Therapeutisches Drug Monitoring (konzentrationsabhängige Toxizität einer Substanz, enger therapeutischer Bereich, Zusammenhang zwischen Plasmakonzentration und Wirkung bzw. Nebenwirkung, geringe intra-, hohe interindividuelle Variabilität der Plasmakonzentrationen, Verfügbarkeit einer raschen und präzisen analytischen Nachweismethode) werden von Ribavirin erfüllt.
Da der initialen Ribavirin-Exposition eine große prädiktive Bedeutung im Hinblick auf das frühe und auch das bleibende Ansprechen der HCV-Therapie zukommt, ist ein TDM von Ribavirin insbesondere zu Beginn der Behandlung hilfreich. Über die erforderlichen Ziel-Konzentrationen von RBV herrscht allerdings noch keine absolute Klarheit (Übersicht bei Morello et al., 2008). Einerseits sind hohe Konzentrationen zur Erzielung eines bestmöglichen Behandlungserfolges wünschenswert, andererseits steigt mit zunehmender Plasmakonzentration das Toxizitätsrisiko, insbesondere die Ribavirin-assoziierte Anämie, rasch an. Auf der Basis der bisher verfügbaren Daten sollten RBV-Plasmakonzentrationen zwischen ca. 1.700 und 2.300 ng/ml angestrebt werden. Die Durchführung weiterer Studien hierzu erscheint jedoch dringend erforderlich.
Aufgrund der RBV-Pharmakokinetik könnte auch ein modifiziertes Dosisregime zu Beginn der Behandlung im Sinne einer RBV-„loading-dose“ oder RBV-Monotherapie-Vorphase den Therapieerfolg weiter verbessern.
Ribavirin - Pharmakokinetik
Ribavirin wird nach oraler Einnahme rasch resorbiert, eine maximale Serumkonzentration wird nach ca. 1,5 Stunden erreicht. Nach einer schnellen Verteilungsphase erfolgt eine langsame Elimination (bei Einmalgabe 79 Stunden, nach multipler Dosierung ca. 298 Stunden!) letztlich über die Nieren.
Ribavirin wird sehr gut resorbiert. Die Bioverfügbarkeit beträgt dennoch lediglich 50%, was wahrscheinlich auf einen erheblichen first-pass-Metabolismus zurückgeht. Ribavirin bindet nicht an Plasmaproteine. Ribavirin akkumuliert in erheblichem Maße in Erythrozyten, hier findet sich bei multipler Dosierung eine um den Faktor 50-70 höhere Konzentration als im Serum.
Ein Steady-state wird grundsätzlich nach ca. 4-6 Halbwertszeiten erreicht, was für Ribavirin bedeutet, dass mit Steady state-Konzentrationen erst nach etwa 4 bis maximal 7-11 Wochen gerechnet werden kann.
Ribavirin-Plasmakonzentration
Zur Ribavirin-Plasmakonzentration im Rahmen der Behandlung der HCV-Infektion sowohl bei Monoinfizierten als auch HCV/HIV-Koinfizierten liegen inzwischen Daten aus mehreren kleineren und größeren Studien vor.
Larrat und Mitarbeiter (2003) fanden bei 11 Patienten mit Therapie-Response nach 12 und 24 Wochen signifikant höhere RBV-Plasmakonzentrationen als bei Nonrespondern. Die mittlere RBV-Plasmakonzentration bei allen Patienten betrug 2.670 ± 1.060 ng/ml in Woche 12 sowie 3.240 ± 1.350 ng/ml in Woche 24 bei einer erheblichen interindividuellen Variabilität (Variabilitätskoeffizient adjustiert an die verabreichte Dosis 44-48%).
Bei 108 konsekutiven Patienten unter Interferon-/Ribavirin-Therapie wurde zu Therapiewoche 4, 8 und 12 zusammengenommen eine mittlere RBV-Konzentration von 1.998 ng/ml gemessen. Die RBV-Plasmakonzentration hatte bezüglich der Entwicklung einer Ribavirin-induzierten Anämie einen deutlich besseren Vorhersagewert als die Ribavirin-Dosierung pro kg Körpergewicht (Lindahl et al., 2004).
In einer japanischen Untersuchung wurden bei 19 Patienten unter einer täglichen RBV-Dosierung von 600-800 mg maximale steady-state-RBV-Plasmakonzentrationen von 1.100-4.200 ng/ml gemessen. Ein steady-state wurde nach 4 Wochen erreicht, die Ribavirin-Clearance korrelierte mit der Nierenfunktion, gemessen als Kreatinin-Clearance. Eine lineare Beziehung fand sich zwischen der Ribavirin-Plasmakonzentration und dem Abfall der Hämoglobin-Konzentration (Maeda et al., 2004).
Bei 98 HCV/HIV-koinfizierten Patienten, die im Rahmen der HCV-Therapie 800-1.200 mg/d Ribavirin erhielten, wurden zu Therapiewoche 4 und 12 die RBV-Plasmakonzentrationen bestimmt (Rendón et al., 2005). Die RBV-Plasmaspiegel korrelierten signifikant mit der RBV-Dosierung pro kg Körpergewicht. Darüber hinaus erwies sich die Ribavirin-Plasmakonzentration sowohl in der univariaten als auch in der multivariaten Analyse als unabhängiger Prädiktor für ein frühes virologisches Therapieansprechen und die Entwicklung einer Ribavirin-assoziierten Anämie. Letztere war ebenfalls assoziiert mit der gleichzeitigen Einnahme von Azidothymidin (AZT). Die mittleren RBV-Plasmakonzentrationen betrugen 2.710 ± 1.070 ng/ml zu Woche 4 und 2.720 ± 890 ng/ml in Woche 12. Bei großer interindividueller Variabilität war die intraindividuelle Variabilität zwischen Woche 4 und 12 gering.
Als unabhängiger Faktor für ein frühes virologisches Ansprechen wurde die RBV-Exposition auch von Núñez et al. (2005) identifiziert. Sie untersuchten in einer prospektiven Studie bei 198 HCV/HIV-koinfizierten Patienten die Prädiktoren für ein virologisches Ansprechen zu Woche 4 und Woche 12. Zu demselben Ergebnis kamen Arase et al. (2005) in einer Untersuchung an 68 HCV-monoinfizierten Patienten. Snoeck et al. (2006) fanden im Rahmen einer Analyse von gepoolten Daten aus mehreren Studien mit insgesamt 1.732 Patienten für eine sustained virological response (SVR) allerdings lediglich einen Zusammenhang zur Ribavirin-Exposition beim HCV-Genotyp 1, nicht jedoch beim Genotyp 2/3.
Eine Studie bei 31 Patienten mit
HCV-Monoinfektion (darunter 23 frühere Non-Responder) konnte einen
signifikanten Unterschied der RBV-Plasmakonzentrationen zu Woche 4 zwischen
Patienten mit nachfolgendem Non-
Response (mittlere
RBV-Konzentration 1.620 ng/ml) und solchen mit nachfolgendem SVR (mittlere
RBV-Konzentration 2.280 ng/ml) zeigen (Maynard et al., 2008). Für eine
cut-off-Konzentration von 2.000 ng/ml zur Woche 4 ergab sich eine Sensitivität
von 73% und eine Spezifität von 80%. Während bei einer RBV-Konzentration
>2.000 ng/ml 67% der Patienten eine SVR erzielten, waren es bei einer
RBV-Konzentration <2.000 ng/ml lediglich 16%.
Marucco und Mitarbeiter (2008) konnten eine signifikante Korrelation zwischen RBV-Talspiegeln und sowohl einer EVR als auch einem SVR nur für den HCV-Genotyp 1 zeigen. Als geeigneter cut-off-Wert für die Vorhersage eines Therapie-Ansprechens bzw. -Nicht-Ansprechens wurde eine RBV-Konzentration von 1.600 ng/ml ermittelt. Eine RBV-Konzentration von >2.300 ng/ml war assoziiert mit einem Hb-Abfall von >4 g/dl.
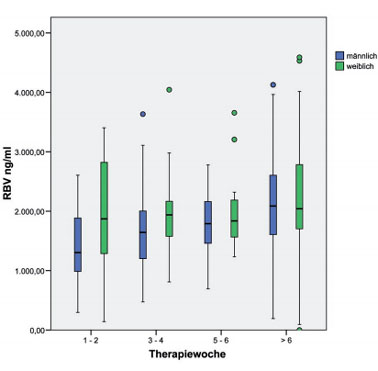
Abb. 1: Mittlere RBV-Plasmakonzentrationen in unterschiedlichen Therapiewochen bei Frauen und Männern mit chronischer HCV-Infektion im Rahmen der antiviralen Therapie mit PEG-Interferon-alfa und Ribavirin (n = 190), Schwerpunkt Infektiologie, Medizinische Klinik II, Universitätsklinikum Würzburg)
In einer Pilotstudie erhielten 10 Patienten mit HCV-Genotyp 1-Monoinfektion eine Ribavirin-Hochdosis-Therapie, initial kalkuliert anhand pharmakokinetischer Formeln unter besonderer Berücksichtigung der Nierenfunktion. Im weiteren Verlauf wurde die RBV-Dosis entsprechend aktueller RBV-Plasmakonzentrationen angepasst, wobei Konzentrationen >3.650 ng/ml angestrebt wurden. Die mittlere verabreichte Dosierung in Woche 24 lag bei 2.540 mg Ribavirin/d. Die RBV-assoziierte Anämie wurde mit Erythropoetin und Transfusionen behandelt. Bei 9 der 10 Patienten konnte ein anhaltendes virologisches Ansprechen erzielt werden (Lindahl et al., 2005).
Eigene Ergebnisse
Mittels HPLC (solid phase extraction-HPLC-Methodik auf der Grundlage der Arbeiten von Homma et al. [1999] und Larrat et al. [2003]) wurden bei 281 konsekutiven HCV-Patienten, 63% HCV-Genotyp 1, 8% Genotyp 2, 27% Genotyp 3 und 2% Genotyp 4, im Therapieverlauf insgesamt 1.320 RBV-Spiegel gemessen und im Hinblick auf die Konzentrationsentwicklung in den ersten Therapiewochen, geschlechtsspezifische Unterschiede, die Korrelation zur Dosierung/kg Körpergewicht, zur Einnahme einer Mahlzeit zum Zeitpunkt der RBV-Einnahme, zum Zeitabstand zur RBV-Einnahme sowie zum RBV-assoziierten HB-Abfall analysiert.
Die mittlere RBV-Tal-Konzentration (Auswertung auf der Basis der ersten 190 Patienten) stieg langsam von 1.531 ± 759 ng/ml in Woche 1-2 auf 1.749 ± 649 ng/ml in Woche 3-4 und 1.882 ± 578 ng/ml in Woche 5-6 an. Im sicheren steady-state nach Woche 6 wurde ein mittlerer RBV-Spiegel von 2.149 ± 786 ng/ml erreicht. Frauen wiesen durchweg höhere RBV-Spiegel auf als männliche Patienten (Abb. 1). Die Unterschiede waren allerdings nicht statistisch signifikant. Patienten mit einem frühen virologischen Ansprechen zeigten in der frühen Behandlungsphase eine signifikant höhere mittlere RBV-Konzentration als Patienten ohne EVR (Woche 1-2: 1.633 ng/ml bei Patienten mit EVR vs. 1.010 ng/ml bei Patienten ohne EVR; p <0,05 (Abb. 2) Klinker et al., 2008).
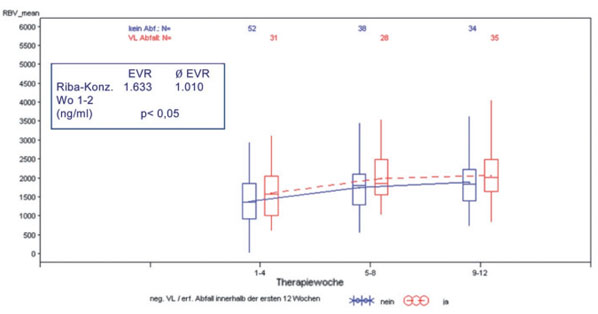
Abb. 2: RBV-Plasmakonzentrationen bei Patienten mit chronischer HCV-Infektion im Rahmen der antiviralen Therapie mit PEG-Interferon-alfa und Ribavirin mit und ohne early virological response (EVR) in Therapiewoche 1-4, 5-8 und 9-12 (n = 83, Schwerpunkt Infektiologie, Medizinische Klinik II, Universitätsklinikum Würzburg)
Die gemessenen RBV-Konzentrationen zeigten eine deutliche intra- und vor allem interindividuelle Varianz. Die mittlere RBV-Konzentration betrug bei nüchterner RBV-Einnahme 2.118 ± 899 ng/ml, bei Einnahme einer leichten Mahlzeit 2.069 ± 968 ng/ml, bei Einnahme einer schwereren Mahlzeit 2.078 ± 871 ng/ml.
Es fand sich eine geringe (Spearmann Rho 0,193), jedoch hochsignifikante (p = 0,003) Korrelation der Ribavirin-Konzentration zur Dosierung/kg Körpergewicht. Eine mäßiggradige (Spearmann Rho -0,1405), hochsignifikante (p <0,001) Korrelation fand sich zum maximalen Hb-Abfall (Klinker et al., 2009).
Arase, Y, Ikeda K, Tsubota A et al. Significance of ribavirin serum concentration in combination therapy of interferon and ribavirin for chronic hepatitis C. Intervirology 2005; 48: 138-144
Homma, M, Jayewardene AL, Gambertoglio J, Aweeka F. High-performance liquid chromatographic determination of ribavirin in whole blood to assess disposition in erythrocytes. Antimicrob Agents Chemother 1999; 43: 2716-9
Klinker, H, Heinz W, Trebesch I et al. Ribavirin-Plasmakonzentrationen in der antiviralen Therapie der chronischen Hepatitis C. Z Gastroenterol 2008;46: 953 (Abstract)
Klinker, H, Keller D, Kahle K et al. Untersuchungen zur Pharmakokinetik von Ribavirin in der antiviralen Therapie der chronischen Hepatitis C. Z Gastroenterol 2009;47: 153 (Abstract)
Larrat, S., Stanke-Labesque F, Plages A et al.. Ribavirin quantification in combination treatment of chronic hepatitis C. Antimicrob Agents Chemother 2003; 47: 124-9.
Lindahl, K, Schvarcz R, Bruchfeld A et al.. Evidence that plasma concentration rather than dose per kilogram body weight predicts ribavirin-induced anemia. J Viral Hep 2004; 11: 84-7
Lindahl, K, Stahle L, Bruchfeld A et al. High-dose ribavirin in combination with standard dose peginterferon for treatment of patients with chronic hepatitis C. Hepatology 2005; 41: 275-279
Loustaud-Ratti, V, Alain S, Rousseau A et al. Ribavirin exposure after the first dose is predictive of sustained virological response in chronic hepatitis C. Hepatology 2008; 47: 1453-1461
Maeda, Y, Kiribayashi Y, Moriya T et al.. Dosage adjustment of ribavirin based on renal function in japanese patients with chronic hepatitis C. Ther Drug Monit 2004; 26: 9-15
Núñez, M, Camino N, Ramos B et al.. Impact of ribavirin exposure on early virological response to hepatitis C therapy in HIV-infected patients with chronic hepatitis C. Antivir Ther 2005; 10: 657-62
Marucco, DA, de Requena G, Bonora S et al. The use of trough ribavirin concentration to predict sustained virological response and haematological toxicity in HIV/HCV-co-infected patients treated with ribavirin and pegylated interferon. J Antimicrob Chemother 2008; 61: 919-924
Maynard, M, Pradat P, Gagnieu MC et al. Prediction of sustained virological response by ribavirin plasma concentration at week 4 of therapy in hepatitis C virus genotype 1 patients. Antivir Ther 2008; 13: 607-611
Morello, J, Rodríguez-Novoa S, Jiménez-Nácher I et al. Usefulness of monitoring ribavirin plasma concentrations to improve treatment response in patients with chronic hepatitis C. J Antimicrob Chemother 2008; 62: 1174-1180
Núñez, M, Camino N, Ramos B et al. Impact of ribavirin exposure on early virological response to hepatitis C therapy in HIV-infected patients with chronic hepatitis C. Antiviral Therapy 2005; 10: 657-662
Parker, WB. Metabolism and antiviral activity of ribavirin. Virus Research 2005; 107: 165-171
Ramos, B, Núñez M, Rendón AL et al. Critical role of ribavirin for the achievement of early virological response to HCV therapy in HCV/HIV-coinfected patients. J Viral Hepatitis 2007; 14: 387-391
Rendón, AL, Núñez M, Romero M et al. Early monitoring of ribavirin plasma concentrations may predict anemia and early virological response in HIV/hepatitis C virus-coinfected patients. J Acquir Immune Defic Syndr 2005; 39: 401-5
Snoeck, E, Wade JR, Duff F et al. Predicting sustained virological response and anaemia in chronic hepatitis C patients treated with peginterferon alfa-2a (40KD) plus ribavirin. Br J Clin Pharmacol 2006; 62: 699-709





