Wolfram H. Gerlich, Giessen HBsAg-Quantifizierung Warum und wie?
Dies hatte mehrere Ursachen:
- 1Die Diagnostika-Hersteller scheuten den zusätzlichen Aufwand einer quantitativen Eichung ihrer Tests.
- Die Kliniker erlagen einem Schwarz-Weiß-Denken und begnügten sich mit einem Positiv/Negativ-Befund.
- Die Forscher und Institutionen, die quantitative Verfahren und Referenzpräparate entwickelten, waren sich nicht einig und schufen ein Wirrwarr widersprüchlicher, z.T. falscher Maßeinheiten für HBsAg (s.u.).
Gründe für HBsAg-Quantifizierung
Dabei gibt es viele gute Gründe, HBsAg quantitativ zu messen und gut definierte klinisch relevante Referenzpräparate zu verwenden.
- Selbst wenn die HBsAg-Menge bei reinen Screeningtests nicht interessiert, ist es doch für die objektive Feststellung der analytischen Sensitivität und die Qualitätssicherung der Diagnostik notwendig, Referenzpräparate mit definiertem zuverlässig konstantem HBsAg-Gehalt zu verwenden. Hierfür stehen seit 1975 Standardpräparate des Paul-Ehrlich-Instituts (PEI) (Gerlich & Thomssen 1975), seit 1984 auch der WHO zur Verfügung (Ferguson et al. 2003).
- Die HBsAg-Konzentration im Serum ist ein indirektes Maß für Zahl und Expressionsaktivität der intrahepatischen cccDNA-Formen des HBV-Genoms. Bei geringer HBV-spezifischer Immunabwehr und Vorliegen von HBeAg korreliert die Gesamtmenge des zirkulierenden HBsAg sehr gut mit der Zahl der zirkulierenden HBV-Partikel (gemessen durch realtime PCR auf HBV-DNA). In einer von der WHO und dem PEI initiierten Studie zu Referenzpräparaten für HBsAg und HBV-DNA (M. Chudy et al. 2009) betrug das Verhältnis von HBsAg in den Viruspartikeln zu der Menge an subviralen 20 nm HBsAg-Partikeln bei allen acht bekannten HBV-Genotypen 1:2700 ± 1300. Dieses Verhältnis gilt allerdings nur für HBV-Träger mit HBeAg und >107 IU/ml HBV-DNA (W. Gerlich, in Vorbereitung). Starke Abweichungen von diesem Verhältnis sprechen dafür, dass entweder das Verhältnis von HBsAg-Expression zu HBV-RNA-Prägenom-Expression (und/oder Transkription, Translation, Sekretion) untypisch ist oder dass es eine selektive starke Suppression der HBV-Reifung durch Therapie oder Immunabwehr gibt. In Extremfällen kann das HBsAg in den üblichen Immunassays stark positive Signale liefern, während HBV-DNA selbst mit empfindlicher Nukleinsäureamplifikationstechniken (NAT) nicht nachweisbar ist.
- Selbstverständlich kann es aber keine HBsAg-Expression
ohne intrazelluläre HBV-DNA geben. In der Tat wurde auch und gerade bei
erfolgreich therapierten Patienten eine gute Korrelation
zwischen der HBsAg-Konzentration im Serum und der intrahepatischen cccDNA gefunden (siehe J. Petersen, Seite 24). Eine Leber-Biopsie ist natürlich viel schwieriger zu erhalten als eine Serumprobe und auch die quantitative Bestimmung der cccDNA ist im Gegensatz zur quantitativen HBsAg-Bestimmung nur in wenigen Forschungslaboratorien möglich.
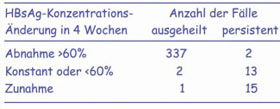
Abb. 1: Prognose der akuten Hepatitis B. Deutschland, 1970er
Jahre, 370 Fälle, bioptisch bestätigt. Gerlich,
Stamm, Thomssen Verh. Dtsch.Ges.
Inn.Med. 1977, 83,554-557

Abb. 2: Prognostischer Wert der
HBsAg-Konzentration vor Interferontherapie. Düsseldorf, 1990er, 96 chronische
HB-Patienten. Erhardt et al. Hepatology
2000; 31:716-725

Abb. 3: HBsAg-Bestimmung bei
Therapie-Monitoring. Moucari et al.
Hepatology 2009 April 49(4):1151-7
- Aufgrund dieser Umstände ist es naheliegend, das HBsAg quantitativ zu bestimmen. Schon in den 1970er Jahren wurde gezeigt, dass eine Abnahme der HBsAg-Menge um mehr als 60% innerhalb von 4 Wochen nach Krankheitsbeginn das Ausheilen einer akuten Hepatitis B anzeigt, während eine geringere Abnahme bzw. Konstanz oder Zunahme in über 90% von Chronifizierung gefolgt war (Gerlich et al. 1977, Abb. 1). Spätere engmaschigere Messungen der HBV-DNA- und HBsAg-Kinetik bei Patienten mit akuter Hepatitis B zeigten, dass die Halbwertszeit des HBsAg zunächst bei 8 Tagen lag, aber nach 4 Wochen auf 6 Tage abgenommen hat, so dass sich also die HBsAg-Elimination im Verlauf der Krankheit auf Grund der Immunantwort beschleunigte und schließlich zum völligen Verschwinden führte. Die Halbwertszeit der HBV-DNA war dagegen zunächst sehr kurz – 1,6 Tage – nahm aber immer mehr zu, so dass im Endeffekt die HBV-DNA auf niedrigem Niveau persistierte (Chulanov et al. 2003).
- In zwei älteren Studien zur Therapie mit Interferon wurde gezeigt, dass eine niedrige HBsAg-Konzentration vor Therapie unter 30.000 PEI-Einheiten/ml mit einem bleibenden Erfolg (HBeAg-Serokonversion, Normalisierung der Transaminasen) verknüpft war (Burczynska et al. 1994; Erhardt et al. 2000). Dies gilt aber nur für HBeAg-positive Patienten (Abb. 2). Leider wurden diese älteren Befunde wenig beachtet.
- In den letzten Jahren wurde das Hauptaugenmerk auf die Veränderung der HBsAg-Konzentration unter und nach Interferontherapie gelenkt (s. J. Petersen, S. 24). Charakteristisch für die Interferontherapie ist, dass sie bei einigen Patienten noch Jahre nach Therapie-Ende zu einem Verschwinden des HBsAg führt, was sich allerdings schon zu Therapie-Ende durch niedrige HBsAg-Konzentrationen ankündigt (Brunetto et al. 2009). Noch bedeutsamer ist, dass sich der relativ seltene langfristige Erfolg einer 48-wöchigen Interferontherapie schon während der Therapie durch eine stetige Abnahme des HBsAg erkennen lässt, wobei eine Abnahme um mehr als eine halbe 10log-Stufe innerhalb von 12 Wochen einen negativen Vorhersagewert von 90% und einen positiven Vorhersagewert von 89% hat (Moucari et al. 2009; Abb. 3). Angesichts der Tatsache, dass nur 21% bzw. 25% sich einer anhaltenden Heilung (sustained viral response, SVR) nach langfristiger Therapie (48 Wochen) erfreuen, ist ein frühes Erkennen des späteren Erfolgs bzw. Misserfolgs bereits nach 12 Wochen ein sehr wesentlicher Fortschritt. Allerdings handelt es sich bei den beiden Studien nur um retrospektive Analysen, so dass nunmehr prospektive Studien folgen sollten.
Marker für Viruslast in der Leber
Bislang bestand das Therapie-Monitoring ausschließlich auf der quantitativen Messung der „Viruslast“ im Serum. Diese Messung muss sowohl bei Interferon als auch Nukleos/tid-Therapie beibehalten werden.
Wie aber erwähnt, zeigt diese Messung nur die kurzfristige Unterdrückung der Virusreifung und -Sekretion. Die eigentliche Viruslast in der Leber kann dagegen mit der HBsAg-Menge besser abgeschätzt werden, wenngleich es große individuelle Unterschiede zwischen intrazellulärer Virusgenomzahl, Expression und tatsächlicher HBsAg-Konzentration geben mag.
Methoden und Einheiten
Für zukünftige Studien wird es sehr wesentlich sein, die HBsAg-Konzentration untereinander zu vergleichen, sofern man sich darauf verlassen kann, dass die Messmethoden richtig geeicht sind. Dann wird es auch möglich sein, nicht nur die relativen Änderungen der HBsAg-Menge unter Therapie, sondern auch absolute Werte zu Beginn der Therapie bereits in die Therapieplanung einzubeziehen. Die modernen quantitativen Testkits werden mit Hilfe eines WHO-Standardserums in International Units (IU) per ml geeicht. Die früher häufige Angabe in Nanogramm HBsAg-Protein/ml wird von der WHO ausdrücklich abgelehnt, da bei einem internationalen Ringversuch die Nanogramm-Angaben aufgrund unterschiedlich geeichter Referenzpräparate bis zum Faktor 10 voneinander abwichen (Ferguson et al. 2003).
Dennoch ist es möglich, die willkürlichen IU in SI-Einheiten zu eichen, wie dies schon vor 34 Jahren für die PEI-Einheiten gezeigt wurde (Gerlich & Thomssen 1975). Für das zukünftige HBsAg-Genotyp-Panel der WHO wurde in der Mehrzahl der Proben (12/16) eine erstaunlich konstante Beziehung zwischen physikochemisch gemessenen HBsAg-Gehalt in Nanogramm und der HBsAg-Reaktivität im Immunoassay Architect der Fa. Abbott gemessen. Ein Nanogramm entsprach dabei 1,08± 0,13 IU.
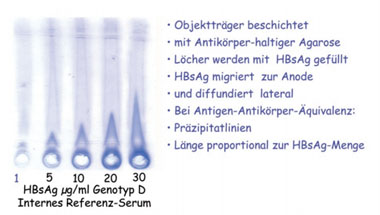
Abb. 4: Quantitative Immun-Elektrophorese (QIE) von HBs-Antigen (Laurell-Elektrophorese). Gerlich und Thomssen, Devel. Biol. Standard 1975. Gerlich et al., 2004. Hepatitis B Virus Protocols
Allerdings gab es auch vier Ausreißer, die z.T. deutlich höhere IU-Werte pro Nanogramm zeigten. Mit dem In-Haus-Test des Autors, der Laurell-Elektrophorese (Abb. 4), wurde dagegen für alle Proben ein Wert von 1,2 IU pro Nanogramm gefunden. Da nicht vorausgesetzt werden kann, dass alle Tests alle Genotypen und Varianten gleich gut erkennen, ist in jedem Fall die Angabe von IU/mL empfehlenswert. Man muss dabei im Auge behalten, dass der Internationale Standard der WHO HBsAg des Genotyps A2 enthält, der nur in Mitteleuropa und den USA häufig ist, während 99% der HBV-Träger weltweit andere Genotypen aufweisen. Unter Beachtung dieser Fakten wird die Anwendung einheitlich geeichter Testkits einen wesentlichen Fortschritt bringen.
Zu beachten ist noch, dass die HBsAg-Mengen zu Beginn einer akuten Hepatitis B oder bei HBeAg-positiver unbehandelter chronischer HBV-Infektion meist sehr hoch sind und im Bereich von 30.000 bis 200.000 IU/ml liegen. Der lineare Messbereich der Testkits reicht dagegen u.U. nur bis (einige) Hundert IU/ml, oft sogar nur bis 10 IU/ml. Dies bedeutet, dass man die Probe so stark verdünnen muss, dass das Ergebnis im linearen Messbereich liegt. Dies erfordert sorgfältige Verdünnungsarbeit und eine individuelle Beurteilung der zu erwartenden HBsAg-Konzentration. Dass eine genaue Messung der HBsAg-Menge von Nöten ist zeigen die bisherigen Studien, wo bereits eine Abnahme um den Faktor 3 innerhalb von 3 Monaten für die Bewertung des Therapie-Erfolgs bedeutsam war. Die Unterschiede zwischen den Respondern und Nonrespondern vor Therapie sind noch geringer. Daher sollte man in Zukunft erwägen, wieder von der logarithmischen Darstellung abzukommen. Diese ist für die Viruslast wegen der sehr großen Unterschiede, aber auch wegen der geringeren Messgenauigkeit sinnvoll, sie nivelliert aber relevante HBsAg-Konzentrationsunterschiede zu stark.
Nach den Erfahrungen des Autors verstehen die meisten Laborärzte die Bedeutung der HBsAg-Quantifizierung bislang nicht und halten die HBV-DNA-Bestimmung für ausreichend. Es wird sicherlich noch eine Reihe guter klinischer Studien sowie sorgsamer methodischer Arbeiten brauchen, bis dieser alte und nun wieder neue Parameter die gebührende Anerkennung gewinnt.
Brunetto MR, Moriconi F, Bonino F, Lau GK, Farci P, Yurdaydin C, Piratvisuth T, Luo K, Wang Y, Hadziyannis S, Wolf E, McCloud P, Batrla R, Marcellin P. (2009). Hepatitis B virus surface antigen levels: a guide to sustained response to peginterferon alfa-2a in HBeAg-negative chronic hepatitis B. Hepatology. Apr;49(4):1141-50
Burczynska B., Madalinski K., Pawlowska J., Woynarowski M., Socha J., Gerlich W.H., Willems W.R., Wozniewicz B., Stachowski J. (1994) The value of quantitative measurement of HBeAg and HBsAg before interferon-a treatment of chronic hepatitis B in children. J. Hepatol. 21:1097-1102
Chudy M, Hanschmann K-M, Kreß J, Gerlich WH, C Nübling M. (2009). Collaborative Study to Establish a World Health Organization International Genotype Panel for Hepatitis B Virus Nucleic Acid Amplification Technique (NAT) –Based Assays. WHO/BS/09.2121
Chulanov, V.P., Shipulin, G.A., Schaefer, S., Gerlich, W.H. (2003). Kinetic of HBV DNA and HBsAg in acute hepatitis B patients with and without coinfection by other hepatitis viruses. J. Med. Virol.69:313-323
Erhardt, A., Reineke, U., Blondin, D., Gerlich W.H., Adams, O., Heintges, R., Niederau, C, Häussinger D. (2000). Mutations of the core promoter and response to interferon treatment in chronic replicative hepatitis B. Hepatology 31 (3): 716-25
Ferguson M, Heath A, Lelie N, Nübling M, Nick S, Gerlich W, Decker R, PadillaA. WHO Working Group on Hepatitis and HIV Diagnostic Kits. Report of a collaborative study to 1) assess the suitability of a candidate replacement International Standard for HBsAg and a reference panel for HBsAg and 2) to calibrate the candidate standard in IU. 2003; http://www.who.int/bloodproducts/cs/en/031987.pdf
Gerlich W. H., Thomssen R. (1975). Standardized detection of hepatitis B surface antigen: determination of its serum concentration in weight units per volume. Develop. biol. standard. Vol 30, 78-87 (S. Karger, Basel)
Gerlich W.H., Stamm, B., Thomssen R. (1977). Prognostic significance of quantitative HBsAg determination with acute hepatitis B. Verh.Dtsch.Ges.Inn.Med. 83, 554-557
Gerlich, W.H., Wend, U., Glebe, D. (2004). Quantitative assay of hepatitis B surface antigen in serum or plasma using Laurell electrophoresis. In: Lau, J., Hamatake, R.: Hepatitis B Virus protocols book, p. 57-63, Humana press, Totowa, N.J.
Moucari R, Mackiewicz V, Lada O, Ripault MP, Castelnau C, Martinot-Peignoux M, Dauvergne A, Asselah T, Boyer N, Bedossa P, Valla D, Vidaud M, Nicolas-Chanoine MH, Marcellin P. (2009). Early serum HBsAg drop: a strong predictor of sustained virological response to pegylated interferon alfa-2a in HBeAg-negative patients. Hepatology. Apr;49(4):1151-7





